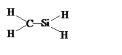
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
B. 密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2NA个P-Cl键
C. 92.0甘油(丙三醇)中含有羟基数为1.0 NA
D. 高温下,0.1molFe与足量水蒸气反应,生成的H2分子数为0.3NA
【答案】A
【解析】
A.过氧化钠与水的反应中,过氧化钠既是氧化剂,又是还原剂,过氧化钠中氧元素的价态由-1价变为0价和-2价,故当生成0.1mol氧气时转移0.2NA个电子,故A正确;
B.PCl3与Cl2生成PCl5的反应为可逆反应,则生成PCl5的物质的量小于1mol,增加的P-Cl键小于2NA,故B错误;
C.92.0g甘油(丙三醇)的物质的量为![]() =1mol,1mol丙三醇含有3mol羟基,即含有羟基数为3NA,故C错误;
=1mol,1mol丙三醇含有3mol羟基,即含有羟基数为3NA,故C错误;
D.铁与水蒸气反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2↑,消耗3mol铁生成4mol氢气,则0.1molFe与足量水蒸气反应生成的H2为
Fe3O4+4H2↑,消耗3mol铁生成4mol氢气,则0.1molFe与足量水蒸气反应生成的H2为![]() mol,数目为
mol,数目为![]() NA,故D错误;
NA,故D错误;
答案选A。

【题目】某化学学习小组用酸性KMnO4溶液与H2C2O4(K1 = 5.4 × 10-2)的反应(此反应为放热反应)进行如下实验:
Ⅰ、探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 molL-1 H2C2O4溶液、0.010 molL-1 KMnO4 溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(H2C2O4溶液)/mL | V(蒸馏水)/mL | V(KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 2.0 | a | 4.0 | 25 |
(1)完成该反应的实验原理: + MnO4- + = CO2↑ + Mn2+ + H2O_______________
(2)上述实验①、②是探究___________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则 a 为___________;乙是实验需要测量的物理量,则表格中“乙”应填写_______________。
Ⅱ、测定H2C2O4xH2O中x值。已知:M(H2C2O4) = 90 gmol-1。①称取1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液; ②取 25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4; ③用浓度为 0.05 000 molL-1的KMnO4标准溶液进行滴定。
(1)某学生的滴定方式(夹持部分略去)如下,最合理的是________(选填 a、b)。由图可知消耗 KMnO4 溶液体积为________ mL。

(2)滴定终点锥形瓶内现象为__________________________________________________。
(3)通过上述数据,求得 x =______________。
(4)下列操作会造成所测x偏大的是____________(填字母)。
A.滴定终点俯视读数
B.锥形瓶用待测溶液润洗
C.滴定前有气泡,滴定后没有气泡
D.配制100 mL待测溶液时,有少量溅出
【题目】![]() 是一种金黄色易挥发的液体,人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通以氯气即可生成
是一种金黄色易挥发的液体,人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通以氯气即可生成![]() 。有关物质的部分性质如下:
。有关物质的部分性质如下:
物质 | 熔点/ | 沸点/ | 化学性质 |
|
|
| 略 |
|
|
| 遇水生成
|
下图是实验室用![]() 和
和![]() 制备
制备![]() 的装置(夹持装置、加热装置均已略去)。
的装置(夹持装置、加热装置均已略去)。

(1)实验室中制备氯气,可以选用如下________(选填字母)装置。

(2)装置![]() 中应放试剂为___________________;装置
中应放试剂为___________________;装置![]() 的名称是__________________。图中
的名称是__________________。图中![]() 装置中应放置的试剂为______________________,其作用为________________________。
装置中应放置的试剂为______________________,其作用为________________________。
(3)该实验的操作顺序应为_____________________________________(用序号表示)。
①加热装置![]() ②通入
②通入![]() ③通冷凝水 ④停止通
③通冷凝水 ④停止通![]() ⑤停止加热装置
⑤停止加热装置![]()
(4)![]() 粗品中可能混有的杂质是(填写两种)_____________、____________,
粗品中可能混有的杂质是(填写两种)_____________、____________,![]() 粗品可以用___方法(填操作名称)进行提纯。
粗品可以用___方法(填操作名称)进行提纯。
(5)对提纯后的产品进行粗略测定。取![]() 产品,加入
产品,加入![]() 水充分反应(假设
水充分反应(假设![]() 全部逸出),过滤,洗涤沉淀并将洗涤液与滤液合并,用
全部逸出),过滤,洗涤沉淀并将洗涤液与滤液合并,用![]() 容量瓶定容,取
容量瓶定容,取![]() 溶液用浓度为
溶液用浓度为![]() 的硝酸银溶液滴定,三次测定结果如下:
的硝酸银溶液滴定,三次测定结果如下:
1 | 2 | 3 |
|
|
|
则产品中氯元素的质量分数为________(用含有![]() 的式子表示)。若锥形瓶用待测液润洗,对滴定结果的影响是__________(选填“偏大”、“偏小”或“不变”)。
的式子表示)。若锥形瓶用待测液润洗,对滴定结果的影响是__________(选填“偏大”、“偏小”或“不变”)。
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c(OH-)/c(H+) E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________。
(4)25℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_____。
(5)标准状况下,将1.12L CO2通入100mL 1mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH-)=2c(H2CO3)+___。