题目内容
9.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的2p轨道上有2个未成对电子,Y元素原子的4p轨道上有3个未成对电子.X跟Y可形成化合物Y2X3,Z元素可以形成正一价离子.请回答下列问题:(1)X元素原子基态时的价电子排布式为2s22p4,X的元素符号是O;
(2)Y元素在元素周期表中的位置是第4周期VA族,Y的元素名称是砷,Y元素价层电子的电子排布图为
 ;
;(3)比较Y的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低,并说明理由NH3>AsH3>PH3、NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高
(4)已知化合物Y2X3在稀硫酸溶液中可被金属锌还原为YZ3,产物还有ZnSO4和H2O,该反应的化学方程式是As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
分析 已知X、Y和Z三种元素的原子序数之和等于42;Y元素原子的4p轨道上有3个未成对电子,Y元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;X元素原子的最外层2p轨道上有2个未成对电子,X的2p轨道上有2个电子或4个电子,所以X为碳元素或氧元素,X跟Y可形成化合物Y2X3,故X为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为:42-8-33=1,则Z为氢元素,氢原子可以形成正一价离子,符合题意.
解答 解:已知X、Y和Z三种元素的原子序数之和等于42;Y元素原子的4p轨道上有3个未成对电子,Y元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;X元素原子的最外层2p轨道上有2个未成对电子,X的2p轨道上有2个电子或4个电子,所以X为碳元素或氧元素,X跟Y可形成化合物Y2X3,故X为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为:42-8-33=1,则Z为氢元素,氢原子可以形成正一价离子,
(1)X为O元素,其原子基态时的价电子排布式为2s22p4;
(2)Y的原子4p轨道上有3个未成对电子,Y元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,元素名称为砷;处于第四周期第ⅤA族,;其价电子的轨道表示式为 ;
;
故答案为:第四周期第ⅤA族; 砷; ;
;
(3)同主族元素为N、P、As,在同主族元素对应的氢化物中,对应的氢化物含有氢键,沸点较高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高,则沸点大小为:NH3>AsH3>PH3;
故答案为:NH3>AsH3>PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高;
(4)X为O元素、Y为As元素,Z为H元素.化合物Y2X3为As2O3,YZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,则反应方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
点评 本题考查结构与位置关系、核外电子排布规律、元素周期律等,难度中等,正确推断元素X、Y是解答关键,注意(4)中氧化还原反应方程式的书写配平.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 氯化钠溶液滴入硝酸银溶液中 Ag++Cl-═AgCl↓ | |
| D. | 次氯酸钙溶液中通入少量CO2 Ca(ClO)2+CO2+H2O═CaCO3↓+2H++2ClO- |
| A. | 用小苏打治疗胃酸过多 | |
| B. | 生石灰作食品干燥剂 | |
| C. | 打磨磁石制指南针 | |
| D. | 酸性重铬酸钾检验司机是否酒后驾车 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 容器内的总压强不随时间变化 | B. | 正、逆反应都还在继续进行 | ||
| C. | XY气体的物质的量分数不变 | D. | X2和Y2的消耗速率相等 |
| A. | 混合物中铝、铁的物质的量之比1:2 | |
| B. | 混合物与稀硝酸反应后的溶液还能溶解1.28g Cu | |
| C. | 将0.28mol气体通人水中并完全被吸收时,需要消耗0.14mol氧气 | |
| D. | 10.7g固体为Al(OH)3和Fe(OH)3的混合物 |
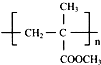 ,以下是有机玻璃的一种合成路线:
,以下是有机玻璃的一种合成路线: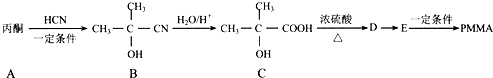
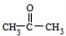 ,A生成B的反应类型是加成反应.
,A生成B的反应类型是加成反应.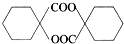 .
.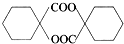 的同分异构体中符合下列条件的有10种(不考虑立体异构);
的同分异构体中符合下列条件的有10种(不考虑立体异构);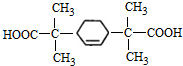 (填结构简式).
(填结构简式).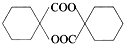 的合成路线:
的合成路线: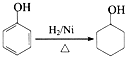 $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$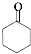 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$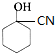 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$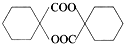 .
.
 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.