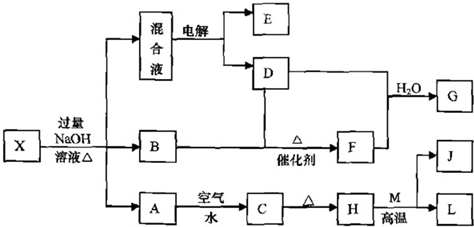
题目内容
浅绿色溶液A和无色溶液B可进行下列反应,D是一种常见的盐,E是气态氢化物,G是非金属氧化物.

(1)填写下列各物质的化学式:A
(2)浅绿色溶液A与NaOH溶液反应先生成白色沉淀,此沉淀迅速变成灰绿色最后变成红褐色,写出此反应过程中的化学方程式
①
②
(3)写出沉淀C与稀盐酸反应生成浅绿色溶液A和气体E的化学方程式:

(1)填写下列各物质的化学式:A
FeCl2
FeCl2
,BNa2S
Na2S
,HFeCl3
FeCl3
;(2)浅绿色溶液A与NaOH溶液反应先生成白色沉淀,此沉淀迅速变成灰绿色最后变成红褐色,写出此反应过程中的化学方程式
①
FeCl2+2NaOH=2NaCl+2Fe(OH) 2↓
FeCl2+2NaOH=2NaCl+2Fe(OH) 2↓
;②
4Fe(OH) 2+O2+2H2O=4Fe(OH) 3
4Fe(OH) 2+O2+2H2O=4Fe(OH) 3
.(3)写出沉淀C与稀盐酸反应生成浅绿色溶液A和气体E的化学方程式:
FeS+2HCl=FeCl2+H2S↑
FeS+2HCl=FeCl2+H2S↑
.分析:溶液D加入硝酸银后生成沉淀不溶于稀硝酸,应为AgCl,且滤液焰色反应呈黄色,则D为NaCl,G可使品红褪色,应为SO2,则E为H2S,H可与KSCN反应呈红色,则H为FeCl3,A为FeCl2,则B为Na2S,结合对应物质的性质以及题目要求可解答该题.
解答:解:溶液D加入硝酸银后生成沉淀不溶于稀硝酸,应为AgCl,且滤液焰色反应呈黄色,则D为NaCl,G可使品红褪色,应为SO2,则E为H2S,H可与KSCN反应呈红色,则H为FeCl3,A为FeCl2,则B为Na2S,
(1)由以上分析可知A为FeCl2,B为Na2S,H为FeCl3,故答案为:FeCl2;Na2S;FeCl3;
(2)浅绿色溶液A与NaOH溶液反应先生成白色沉淀,反应为FeCl2+2NaOH=2NaCl+2Fe(OH) 2↓,此沉淀迅速变成灰绿色最后变成红褐色,反应为4Fe(OH) 2+O2+2H2O=4Fe(OH) 3 ,故答案为:FeCl2+2NaOH=2NaCl+2Fe(OH) 2↓;4Fe(OH) 2+O2+2H2O=4Fe(OH) 3 ;
(3)沉淀C为FeS,可与盐酸反应,反应的化学方程式为FeS+2HCl=FeCl2+H2S↑,故答案为:FeS+2HCl=FeCl2+H2S↑.
(1)由以上分析可知A为FeCl2,B为Na2S,H为FeCl3,故答案为:FeCl2;Na2S;FeCl3;
(2)浅绿色溶液A与NaOH溶液反应先生成白色沉淀,反应为FeCl2+2NaOH=2NaCl+2Fe(OH) 2↓,此沉淀迅速变成灰绿色最后变成红褐色,反应为4Fe(OH) 2+O2+2H2O=4Fe(OH) 3 ,故答案为:FeCl2+2NaOH=2NaCl+2Fe(OH) 2↓;4Fe(OH) 2+O2+2H2O=4Fe(OH) 3 ;
(3)沉淀C为FeS,可与盐酸反应,反应的化学方程式为FeS+2HCl=FeCl2+H2S↑,故答案为:FeS+2HCl=FeCl2+H2S↑.
点评:本题考查无机物的推断,题目难度不大,注意根据反应的现象判断物质的种类,为解答该题的突破口,牢固把握相关元素化合物知识为解答该类题目的前提.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目