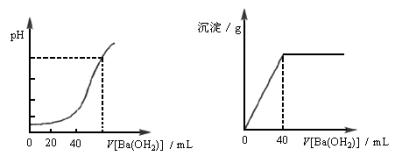
题目内容
用0.05mol×L-1的Ba(OH)2溶液,滴定20mL盐酸和硫酸混合溶液,图甲和乙分别是Ba(OH)
答案:
解析:
解析:
| 解:由已知图示可知:当加入60mL
0.05mol×L-1 Ba(OH)2时,溶液恰好呈中性,当加入40mL 0.05mol×L-1 Ba(OH)2时,溶液中的SO42-恰好沉淀完全。
设H+、SO42-的物质的量浓度分别为xmol×L-1、ymol×L-1,则有
由电荷守恒,得c(H+)=2c(SO42-)+c(Cl-)故溶液中c(Cl-)=c(H+)-2c(SO42-)=(0.3-2´0.1)mol×L-1 =0.1mol×L-1。
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目