题目内容
15.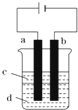 Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.
Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.(1)a电极材料为Fe,其电极反应式为Fe-2e-═Fe2+;
(2)电解液d可以是C,则白色沉淀在电极上生成;也可以是B,则白色沉淀在两极之间的溶液中生成.
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为白色沉淀立即变为灰绿色,最终变为红褐色.
分析 (1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2;
(3)反接电源时,电解的是H2O,生成的O2会将Fe(OH)2氧化.
解答 解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,若白色沉淀在电极上生成,则电解液d是氢氧化钠,若白色沉淀在两极之间的溶液中生成,则电解液d是氯化钠溶液,但是若电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2,则不会出现白色沉淀,
故答案为:C;B;
(3)反接电源时,电解方程式是2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色.
点评 本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
20.铪由于具有低的中子吸收截面,优异的耐蚀性能和加工性能,是核工业的重要材料.其中一种是${\;}_{72}^{185}$Hf铪),下列说法正确的是( )
| A. | ${\;}_{72}^{185}$Hf的质量数为72 | |
| B. | ${\;}_{72}^{185}$Hf的核外电子数为72 | |
| C. | ${\;}_{72}^{185}$Hf的中子数为103 | |
| D. | ${\;}_{72}^{185}$Hf与${\;}_{72}^{179}$Hf互为同素异形体 |
7.下列溶液中的离子一定能大量共存的是( )
| A. | 含大量Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| B. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 含大量OH-的溶液中:Na+、NO3-、K+、AlO2- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、I-、SCN- |
5.某有机物的结构简式为CH2═CHCH2COOH,下列对其化学性质的判断中不正确的是( )
| A. | 能使紫色石蕊变红 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 该有机物不能与NaOH发生反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |

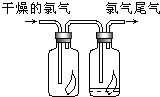 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色