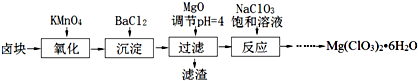
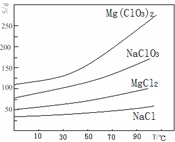
题目内容
下列现象或事实可用同一化学原理解释的是
- A.乙烯可使溴水和酸性高锰酸钾溶液褪色
- B.常温下,可以用铝制容器贮藏浓硫酸和浓硝酸
- C.浓硫酸和浓盐酸暴露在空气中浓度均减小
- D.合成氨工业中采用高温和高压条件均可提高生产效益
B
分析:A、乙烯可以发生加成反应和发生氧化反应;
B、常温下铝在浓硫酸浓硝酸中发生钝化现象;
C、浓硫酸是难挥发性酸,具有吸水性,浓盐酸是易挥发性酸;
D、高温是为了增大反应速率,催化剂活性最大,高压是利用活性平衡移动原理,加压平衡向气体体积减小的方向进行.
解答:A、乙烯可使溴水褪色,发生的是加成反应,使性高锰酸钾溶液褪色是被高锰酸钾溶液氧化,溶液褪色,反应原理不同,故A不符合;
B、常温下铝在浓硫酸浓硝酸中发生钝化现象,在金属表面形成一薄层致密保护膜,常温下,可以用铝制容器贮藏浓硫酸和浓硝酸,故B符合;
C、浓硫酸是难挥发性酸,露置空气中吸收水蒸气,浓度变小,浓盐酸是易挥发性酸;浓盐酸具有挥发性,挥发出氯化氢气体,浓度减小,原理不同,故C不符合;
D、合成氨工业中采用高温是为了增大反应速率,催化剂活性最大,高压条件是增大压强促进平衡正向进行,提高生产效益的原理不同,故D不符合;
故选B.
点评:本题考查了物质性质的分析,反应现象和事实的反应原理理解应用,掌握物质性质是解题关键,题目难度中等.
分析:A、乙烯可以发生加成反应和发生氧化反应;
B、常温下铝在浓硫酸浓硝酸中发生钝化现象;
C、浓硫酸是难挥发性酸,具有吸水性,浓盐酸是易挥发性酸;
D、高温是为了增大反应速率,催化剂活性最大,高压是利用活性平衡移动原理,加压平衡向气体体积减小的方向进行.
解答:A、乙烯可使溴水褪色,发生的是加成反应,使性高锰酸钾溶液褪色是被高锰酸钾溶液氧化,溶液褪色,反应原理不同,故A不符合;
B、常温下铝在浓硫酸浓硝酸中发生钝化现象,在金属表面形成一薄层致密保护膜,常温下,可以用铝制容器贮藏浓硫酸和浓硝酸,故B符合;
C、浓硫酸是难挥发性酸,露置空气中吸收水蒸气,浓度变小,浓盐酸是易挥发性酸;浓盐酸具有挥发性,挥发出氯化氢气体,浓度减小,原理不同,故C不符合;
D、合成氨工业中采用高温是为了增大反应速率,催化剂活性最大,高压条件是增大压强促进平衡正向进行,提高生产效益的原理不同,故D不符合;
故选B.
点评:本题考查了物质性质的分析,反应现象和事实的反应原理理解应用,掌握物质性质是解题关键,题目难度中等.

练习册系列答案
相关题目
下列实验现象所对应的离子方程式不正确的是
| 实验 | 现象 | 离子方程式 | |
| A |  K2SO4 K2SO4Kl淀粉溶液 | 在空气里放置一段时间后溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B |  稀盐酸 稀盐酸稀碳酸钠溶液 | 开始时无气泡,后来有气泡 | CO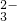 +H+═HCO +H+═HCO HCO  +H+═H2O+CO2↑ +H+═H2O+CO2↑ |
| C |  NaOH溶液 NaOH溶液Cl2水 | 溶液由黄绿色变为无色 | Cl2+2OH-═Cl-+ClO-+H2O |
| D |  H2SO4加有酚酞的 H2SO4加有酚酞的Ba(OH)2溶液 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
- A.A
- B.B
- C.C
- D.D
 如图所示实验装置进行实验(必要时可以进行加热),下列实验现象描述不正确的是
如图所示实验装置进行实验(必要时可以进行加热),下列实验现象描述不正确的是
| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | H2O2 | MnO2 | FeCl2 | 溶液由浅绿色变为棕黄色 |
| B | 浓氨水 | CaO | AgNO3 | 开始有白色沉淀生成,随后白色沉淀减少以至完全消失 |
| C | H2SO4 | Na2SO3 | BaCl2 | 产生白色沉淀 |
| D | 浓HNO3 | Cu | NaHCO3 | 有无色气体生成 |
- A.A
- B.B
- C.C
- D.D
 实验室欲配制0.5mol/LNaOH溶液500mL.
实验室欲配制0.5mol/LNaOH溶液500mL.