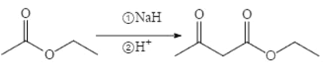
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的有
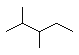
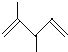
①3lg白磷中含有1.5NA个P-P键
②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA
③标准状况下,22.4LHF 中含有NA个分子
④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜
⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA
⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142gNa2SO4 和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A.2项B.3项C.4项D.5项
【答案】B
【解析】
①3lg白磷中含有P—P键数目![]() ,故①正确;②1L0.1 molL1的Na2CO3溶液中碳酸钠物质的量n =0.1 molL1×1L=0.1mol,碳酸根水解生成碳酸氢根和氢氧根,因此0.1mol碳酸钠溶液中含阴离子的总数目大于0.1NA,故②错误;③标准状况下,HF是液体,因此无法计算分子数目,故③错误;④电解精炼铜时,阳极是粗铜,先锌失去电子,再是铁失去电子,再是铜失去电子,因此转移NA个电子,则阳极溶解铜小于32g,故④错误;⑤将2.24L(标准状况)Cl2物质的量为1mol,氯气溶于水是可逆反应,因此转移的电子数小于0.1NA,故⑤错误;⑥常温下,含有0.2mol H2SO4的浓硫酸与足量铜反应不反应,因此生成SO2分子的数目小于0.1NA,故⑥正确;⑦Na2SO4和Na2HPO4的摩尔质量都为142 gmol1,且两种物质都含有3mol离子,因此142gNa2SO4和Na2HPO4的固体混合物物质的量为1mol,所含阴、阳离子的总数目为3NA,故⑦正确;⑧氢氧化铁胶体粒子是氢氧化铁的集合体,NA个Fe(OH)3胶体粒子的质量为大于107g,故⑧错误;因此①⑥⑦正确;故B正确。
,故①正确;②1L0.1 molL1的Na2CO3溶液中碳酸钠物质的量n =0.1 molL1×1L=0.1mol,碳酸根水解生成碳酸氢根和氢氧根,因此0.1mol碳酸钠溶液中含阴离子的总数目大于0.1NA,故②错误;③标准状况下,HF是液体,因此无法计算分子数目,故③错误;④电解精炼铜时,阳极是粗铜,先锌失去电子,再是铁失去电子,再是铜失去电子,因此转移NA个电子,则阳极溶解铜小于32g,故④错误;⑤将2.24L(标准状况)Cl2物质的量为1mol,氯气溶于水是可逆反应,因此转移的电子数小于0.1NA,故⑤错误;⑥常温下,含有0.2mol H2SO4的浓硫酸与足量铜反应不反应,因此生成SO2分子的数目小于0.1NA,故⑥正确;⑦Na2SO4和Na2HPO4的摩尔质量都为142 gmol1,且两种物质都含有3mol离子,因此142gNa2SO4和Na2HPO4的固体混合物物质的量为1mol,所含阴、阳离子的总数目为3NA,故⑦正确;⑧氢氧化铁胶体粒子是氢氧化铁的集合体,NA个Fe(OH)3胶体粒子的质量为大于107g,故⑧错误;因此①⑥⑦正确;故B正确。
综上所述,答案为B。

【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。