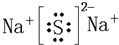题目内容
现有下列短周期元素性质的数据
(1)请将上述九种元素中的③④⑤⑧⑨五种元素符号填入下列短周期表中:
(2)写出③号元素的单质的电子式______、⑤⑨两元素形成的化合物的电子式______
(3)上述九种元素中:______元素的最高价氧化物对应水化物的酸性最强;能形成既含离子键又含共价键的化合物的化学式是______;金属性最强的元素是______;形成气态氢化物的稳定性③比④的______.
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径 *10-10 m |
1.52 | 1.11 | 0.70 | 0.66 | 1.86 | 1.60 | 1.11 | 1.04 | 0.99 |
| 最高正价最低负价 | +1 | +2 | +5 -3 |
-2 |
+1 | +2 | +5 -3 |
+6 -2 |
+7 -1 |
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ||||||||
| 3 | ||||||||
(3)上述九种元素中:______元素的最高价氧化物对应水化物的酸性最强;能形成既含离子键又含共价键的化合物的化学式是______;金属性最强的元素是______;形成气态氢化物的稳定性③比④的______.
(1)由原子半径同周期从左向有减小,同主族从上到下在增大,结合化合价,则③为N,④为O,⑤为Na,⑧为S,⑨为Cl,则它们的位置为
,故答案为:
(2)③为N,单质为N2,其电子式为

,⑤⑨两元素形成的化合物为NaCl,其电子式为

,故答案为:

;

;
(3)上述几种元素中,Cl的非金属性最强,Na的金属性最强,则Cl元素的最高价氧化物对应水化物的酸性最强,④⑤⑨能形成既含离子键又含共价键的化合物为NaClO,、非金属性O大于N,则③的氢化物的稳定性比④的氢化物的稳定性弱,故答案为:Cl;NaClO;Na;弱.
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | N | O | ||||||
| 3 | Na | S | Cl | |||||
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | N | O | ||||||
| 3 | Na | S | Cl | |||||

,⑤⑨两元素形成的化合物为NaCl,其电子式为

,故答案为:

;

;
(3)上述几种元素中,Cl的非金属性最强,Na的金属性最强,则Cl元素的最高价氧化物对应水化物的酸性最强,④⑤⑨能形成既含离子键又含共价键的化合物为NaClO,、非金属性O大于N,则③的氢化物的稳定性比④的氢化物的稳定性弱,故答案为:Cl;NaClO;Na;弱.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目