题目内容
下述实验设计能够达到目的的是
编号 | 实验目的 | 实验设计 |
A. | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
B. | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
C. | 检验溶液中是否含有Fe2+ | 向溶液中滴人氯水水后,再滴加KSCN 溶液 |
D. | 证明H2CO3酸性比H2SiO3强 | 将CO2通人Na2SiO3溶液中 |
D
【解析】
试题分析:A.将混合气体通过饱和Na2CO3溶液, CO2、SO2都发生反应,不能达到除杂的目的,错误;B.Cu、CuO都能与稀硝酸发生反应,因此不能达到除杂的目的,错误;C.若向溶液中滴入氯水,溶液中的Fe2+会被氧化为Fe3+,因此再滴加KSCN 溶液,溶液变为红色,可能是Fe2+会被氧化为Fe3+,也可能是原溶液就含有Fe3+,不能检验离子的存在,错误;D. 将CO2通入Na2SiO3溶液中,会发生反应:CO2+H2O+Na2SiO3= H2SiO3↓+ Na2CO3,可以证明酸性H2CO3> H2SiO3,正确。
考点:考查化学实验方案的设计的正误判断的知识。

(11分)应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) △H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H = -566.0 kJ/mol
H2O(g)=H2O(1) △H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g) 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为 。

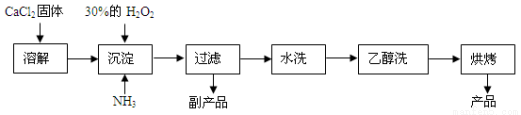
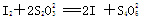 】
】