题目内容
(14分)过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
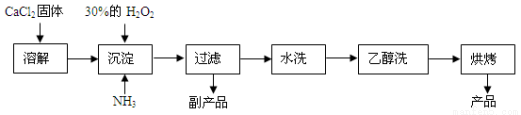
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: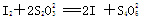 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
(14分)(1)CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl (2分)
(2)可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(2分);
②该反应是放热反应,温度低有利于提高CaO2·8H2O产率(2分)。
(4)① ,(2分)
,(2分)
②偏高(2分),在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3
增多,从而使测得的CaO2的质量分数偏高。(2分)
【解析】
试题分析:(1)向氯化钙溶液中加入过氧化氢、氨气可得到过氧化钙沉淀晶体,同时产物中有氯化铵,所以化学方程式是CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl;
(2)过氧化钙晶体上可能含有氯离子,所以检验水洗是否干净则检验水洗后的溶液中是否含有氯离子即可。具体操作如下:可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。
(3)因为过氧化氢在加热时会分解,从而降低过氧化氢的使用率,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;同时考虑过氧化钙的沉淀程度,该反应可能是放热反应,温度低对过氧化钙的沉淀有利;
(4)①根据得失电子守恒,过氧化钙与碘之间的关系式是CaO2~I2,而碘与Na2S2O3之间的关系式是2Na2S2O3~I2,所以CaO2~I2~2Na2S2O3,则过氧化钙的物质的量是Vc×10-3/2mol,所以过氧化钙的质量分数是Vc×10-3/2mol×72g/mol/ag×100%=
②若滴速太慢,则I-被空气中的氧气氧化为碘,则消耗Na2S2O3溶液体积增多,从而使测得的CaO2的质量分数偏高。
考点:考查制备实验方案的设计,物质质量分数的计算,化学方程式的书写

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案下述实验设计能够达到目的的是
编号 | 实验目的 | 实验设计 |
A. | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
B. | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
C. | 检验溶液中是否含有Fe2+ | 向溶液中滴人氯水水后,再滴加KSCN 溶液 |
D. | 证明H2CO3酸性比H2SiO3强 | 将CO2通人Na2SiO3溶液中 |
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
 Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平) cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为