题目内容
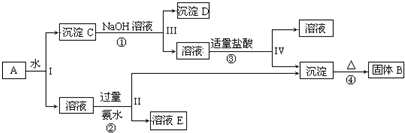
6.工业上用铝土矿(主要成分为Al2O3,还有少量泥沙、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,提取的操作过程如下:(1)在步骤Ⅰ、Ⅱ步骤中的过滤操作中,用到的玻璃仪器除漏斗、烧杯外,还有玻璃棒.
(2)滤液X中含铝元素的溶质的化学式为NaAlO2.
(3)实验室里常往AICl3溶液中加人氨水来制取A1(OH)3,不用NaOH溶液的原因是OH-+Al(OH)3=AlO2-+2H2O(用离子方程式表达).
(4)由A1(OH)3加热得到固体N的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(5)将5.4g铝粉与24.0gFe2O3在高温下隔绝空气充分反应后,生成Fe11.2g.

分析 铝土矿(主要成分为Al2O3,还有少量泥沙、Fe2O3等杂质)中加入氢氧化钠时,则在Ⅰ中得到滤液X中含有偏铝酸根离子、硅酸根离子,沉淀M为氧化铁,滤液X中通入二氧化碳,并控制一定的反应条件,过滤后得氢氧化铝固体和滤液Y主要含有硅酸根离子和碳酸根离子等,氢氧化铝受热分解得固体N为氧化铝,
(1)根据过滤操作的装置答题;
(2)在碱性条件下铝元素以偏铝酸根离子的形式存在;
(3)A1(OH)3是两性氢氧化物,既溶液强酸又溶于强碱;
(4)A1(OH)3加热分解得到氧化铝和水;
(5)铝粉与Fe2O3在高温下隔绝空气发生铝热反应,根据方程式可进行计算.
解答 解:铝土矿(主要成分为Al2O3,还有少量泥沙、Fe2O3等杂质)中加入氢氧化钠时,则在Ⅰ中得到滤液X中含有偏铝酸根离子、硅酸根离子,沉淀M为氧化铁,滤液X中通入二氧化碳,并控制一定的反应条件,过滤后得氢氧化铝固体和滤液Y主要含有硅酸根离子和碳酸根离子等,氢氧化铝受热分解得固体N为氧化铝,
(1)根据过滤操作的装置可知,过滤操作中,用到的玻璃仪器是漏斗、烧杯、玻璃棒,
故答案为:玻璃棒;
(2)在碱性条件下铝元素以偏铝酸根离子的形式存在,所以滤液X中含铝元素的溶质为偏铝酸钠,化学式为NaAlO2,
故答案为:NaAlO2;
(3)A1(OH)3是两性氢氧化物,既溶液强酸又溶于强碱,所以NaOH容易将生成A1(OH)3的溶解,反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(4)A1(OH)3加热分解得到氧化铝和水不,反应的方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(5)铝粉与Fe2O3在高温下隔绝空气发生铝热反应,反应的方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,根据方程式可知铝粉与Fe2O3的质量比为27:80,所以5.4g铝粉与24.0gFe2O3反应,Fe2O3过量,所以生成Fe的质量根铝粉计算,生成Fe的质量为$\frac{5.4×2×56}{54}$g=11.2g,
故答案为:11.2.
点评 本题以框图题形式考查铝的化合物的性质,难度中等,清楚提取的操作过程原理,是对知识迁移的综合运用.

| A. | 需加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件一定能发生 | |
| C. | 反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 | |
| D. | 当△H<0时表明反应为吸热反应 |
| A. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| B. | 往AlCl3溶液中滴加NaHCO3溶液:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 往AgI悬浊液中滴加Na2S饱和溶液:2Ag++S2-═Ag2S↓ | |
| D. | Cu(NO3)2溶液电解的离子方程式:2Cu2++2H2O═2Cu+O2↑+4H+ |
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)MnO4- 氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧话务沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4- 可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
| A. | 2-甲基丙烷 正丁烷 | B. | 氧气 臭氧 | ||
| C. |  | D. | 金刚石 石墨 |

 如图是一个化学过程的示意图.已知甲池的总反应式为:
如图是一个化学过程的示意图.已知甲池的总反应式为: