题目内容
2.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
分析 A、溶液体积不明确;
B、根据反应后钠元素的价态为+1价来分析;
C、标况下,三氧化硫为固体;
D、求出铁的物质的量,然后根据铁与盐酸反应后变为+2价、与氯气反应后变为+3价来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、无论反应后生成的是氧化钠还是过氧化钠,钠元素的价态均变为+1价,故1mol钠均失去1mol电子,故B正确;
C、标况下,三氧化硫为固体,故不能利用气体摩尔体积来计算其物质的量,故C错误;
D、5.6g铁的物质的量为0.1mol,而铁与盐酸反应后变为+2价,即0.1mol铁失去0.2mol电子,与氯气反应后变为+3价,故0.1mol铁失去0.3mol电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
(1)可以判断该分解反应已经达到化学平衡状态的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”“减小”或“不变”).
(3)氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填“>”“<”或“=”).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”“减小”或“不变”).
(3)氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填“>”“<”或“=”).
17.SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径.请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
(3)甲醇汽油也是一种新能源清洁燃料.工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H=-90kJ•mol-1
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
则 c1= c2(填“>”或“<”或“=”),a=36.
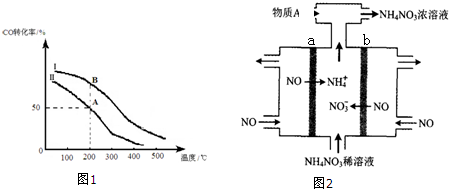
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
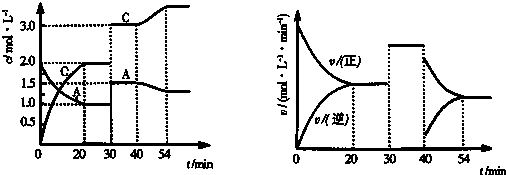
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.

7.能说明苯分子的平面正六边形结构中,碳原子间不是单键与双键交替的事实是( )
| A. | 苯的二元取代物无同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
14.下列有关键线式的说法中错误的是( )
| A. | 将碳、氢元素符号省略,只表示分子中键的连接情况 | |
| B. | 每个拐点、交点、端点均表示有一个碳原子 | |
| C. | 每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数 | |
| D. | C=C、C≡C键等官能团中的“=”和“≡”也可以省略 |
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18gH20中含NA个质子 | |
| B. | 1L 1mol•L一1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24L Cl2中含0.2NA个氯原子 | |
| D. | 0.5mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |

 ;Z的氢化物结构式为
;Z的氢化物结构式为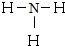 ;写出U元素在周期表中的位置第三周期第VIA族.
;写出U元素在周期表中的位置第三周期第VIA族.