题目内容
 有A、B、C、D、E、M、X七种元素.其相关信息如下:
有A、B、C、D、E、M、X七种元素.其相关信息如下:| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C是电负性最大的元素 |
| ④ | D是主族元素,基态原子有四个能层,且最外能层上只有两个电子 |
| ⑤ | D、E、M、X四种元素处于同一周期; M与E又位于同一族,M的原子序数比E多1,M的基态原子中含有三个未成对电子; X原子外围电子排布式为3d104s1 |
(1)A元素的电负性与B的电负性相比,电负性较大的是
O
O
(填写元素符号).M的原子序数为27
27
;X元素在周期表中的位置是第四周期第IB族
第四周期第IB族
.(2)A与C组成AC3分子的VSEPR模型为
四面体
四面体
,AB3-离子的空间构型为平面三角形
平面三角形
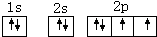
.(3)画出B元素原子的核外电子排布图

1s22s22p63s23p63d5
1s22s22p63s23p63d5
.;(4)E、X晶体晶体的堆积模型依次为体心立方堆积、面心立方最紧密堆积,其配位数依次为
8、12
8、12
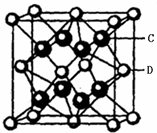
.(5)C与D可形成离子化合物,其晶胞结构如右图所示.若该晶胞的边长为500.0pm.若该晶体的密度为
4.15
4.15
g/cm3(列式并计算).分析:A的基态原子2p轨道中有三个未成对电子,则A原子的电子个数=2+2+3=7,所以A是N元素;
A、B元素的常见单质是构成空气的主要成分,则B是O元素;
C是电负性最大的元素,为F元素;
D是主族元素,基态原子有四个能层,且最外能层上只有两个电子,则D是Ca元素;
D、E、M、X四种元素处于同一周期,都是第四周期,M与E又位于同一族,M的原子序数比E多1,则M和E属于第VIII族,M的基态原子中含有三个未成对电子,则M是Co元素,E是Fe元素,X原子外围电子排布式为3d104s1,则X是Cu,
结合元素和物质的结构来分析解答.
A、B元素的常见单质是构成空气的主要成分,则B是O元素;
C是电负性最大的元素,为F元素;
D是主族元素,基态原子有四个能层,且最外能层上只有两个电子,则D是Ca元素;
D、E、M、X四种元素处于同一周期,都是第四周期,M与E又位于同一族,M的原子序数比E多1,则M和E属于第VIII族,M的基态原子中含有三个未成对电子,则M是Co元素,E是Fe元素,X原子外围电子排布式为3d104s1,则X是Cu,
结合元素和物质的结构来分析解答.
解答:解:A的基态原子2p轨道中有三个未成对电子,则A原子的电子个数=2+2+3=7,所以A是N元素;
A、B元素的常见单质是构成空气的主要成分,则B是O元素;
C是电负性最大的元素,为F元素;
D是主族元素,基态原子有四个能层,且最外能层上只有两个电子,则D是Ca元素;
D、E、M、X四种元素处于同一周期,都是第四周期,M与E又位于同一族,M的原子序数比E多1,则M和E属于第VIII族,M的基态原子中含有三个未成对电子,则M是Co元素,E是Fe元素,X原子外围电子排布式为3d104s1,则X是Cu,
(1)通过以上分析知,A是N元素,B是O元素,同一周期,元素的电负性随着原子序数的增大而增大,所以电负性O元素大于N元素;M的原子序数为27,X元素是Cu元素,其在周期表中的位置是第四周期第IB族,
故答案为:O;27;第四周期ⅠB;
(2)N与F组成NF3分子中N原子价层电子对个数是4,所以它的VSEPR模型为四面体,NO3-离子的中价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,
故答案为:四面体;平面三角形;
(3)O元素原子核外有8个电子,根据构造原理知O元素原子的核外电子排布图 ,Fe3+离子核外有23个电子,根据构造原理知铁离子的核外电子排布式为1s22s22p63s23p63d5,
,Fe3+离子核外有23个电子,根据构造原理知铁离子的核外电子排布式为1s22s22p63s23p63d5,
故答案为: ;1s22s22p63s23p63d5;
;1s22s22p63s23p63d5;
(4)体心立方最密堆积中原子的配位数是8,面心立方最密堆积中配位数=3×8×
=12,所以E、X晶体晶体的堆积模型依次为体心立方堆积、面心立方最紧密堆积,其配位数依次为8、12,
故答案为:8、12;
(5)F与Ca可形成离子化合物,若该晶胞的边长为500.0pm,该晶胞的体积=(500.0×10-10 cm)3,该晶胞中钙离子个数=8×
+6×
=4,氟离子个数=8,所以其化学式为CaF2,
ρ=
=
=
=4.15g/cm3,
故答案为:4.15.
A、B元素的常见单质是构成空气的主要成分,则B是O元素;
C是电负性最大的元素,为F元素;
D是主族元素,基态原子有四个能层,且最外能层上只有两个电子,则D是Ca元素;
D、E、M、X四种元素处于同一周期,都是第四周期,M与E又位于同一族,M的原子序数比E多1,则M和E属于第VIII族,M的基态原子中含有三个未成对电子,则M是Co元素,E是Fe元素,X原子外围电子排布式为3d104s1,则X是Cu,
(1)通过以上分析知,A是N元素,B是O元素,同一周期,元素的电负性随着原子序数的增大而增大,所以电负性O元素大于N元素;M的原子序数为27,X元素是Cu元素,其在周期表中的位置是第四周期第IB族,
故答案为:O;27;第四周期ⅠB;
(2)N与F组成NF3分子中N原子价层电子对个数是4,所以它的VSEPR模型为四面体,NO3-离子的中价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,
故答案为:四面体;平面三角形;
(3)O元素原子核外有8个电子,根据构造原理知O元素原子的核外电子排布图
 ,Fe3+离子核外有23个电子,根据构造原理知铁离子的核外电子排布式为1s22s22p63s23p63d5,
,Fe3+离子核外有23个电子,根据构造原理知铁离子的核外电子排布式为1s22s22p63s23p63d5,故答案为:
 ;1s22s22p63s23p63d5;
;1s22s22p63s23p63d5;(4)体心立方最密堆积中原子的配位数是8,面心立方最密堆积中配位数=3×8×
| 1 |
| 2 |
故答案为:8、12;
(5)F与Ca可形成离子化合物,若该晶胞的边长为500.0pm,该晶胞的体积=(500.0×10-10 cm)3,该晶胞中钙离子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
ρ=
| m |
| V |
| ||
| V |
| ||
| (500.0×10-10cm)3 |
故答案为:4.15.
点评:本题考查了晶胞的计算、核外电子排布式的书写等知识点,难点是晶胞的计算,根据其密度公式来解答,注意cm和pm之间单位的换算,为易错点.

练习册系列答案
相关题目





