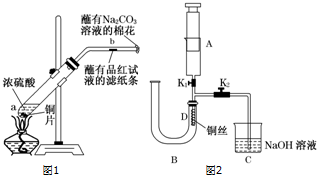
题目内容
14.下列说法错误的是( )| A. | 依原电池的原理设计出化学电源 | |
| B. | 原电池是化学电源的雏形 | |
| C. | 原电池输出电能的能力取决于组成原电池的负极材料的活泼性 | |
| D. | 氧化还原反应所释放出的化学能是化学电池的能量来源 |
分析 A、根据原电池将化学能转变成电能的原理,设计化学电源;
B、化学电源是根据原电池原理设计的,故原电池是化学电源的雏形;
C、原电池输出电能的能力与组成原电池的反应物的氧化还原能力和装置设计的合理性等因素有关;
D、化学电源是根据原电池原理设计的,故氧化还原反应所释放出的化学能是化学电池的能量来源.
解答 解:A、根据原电池将化学能转变成电能的原理,设计化学电源,故A正确;
B、化学电源是根据原电池原理设计的,故原电池是化学电源的雏形,故B正确;
C、原电池输出电能的能力与组成原电池的反应物的氧化还原能力和装置设计的合理性等因素有关,发生氧化还原反应的能力越强,输电能力越强,故C错误;
D、化学电源是根据原电池原理设计的,故氧化还原反应所释放出的化学能是化学电池的能量来源,故D正确.
故选C.
点评 本题考查原电池知识,侧重于化学与能量、原电池的工作原理的考查,难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关于卤素的说法正确的是( )
| A. | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到上层液体呈紫色 | |
| B. | 液溴有强挥发性,保存时应加少量水液封 | |
| C. | Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质 | |
| D. | HX的还原性顺序为:HF>HCl>HBr>HI |
2.某种有机物的结构简式为:

当它完全水解时,可得到的产物有( )

当它完全水解时,可得到的产物有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
3.某化学课外兴趣小组用实验的方法进行影响化学反应速率的因素.
(1)实验一:已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑
△H<0,酸性KMnO4溶液和H2C2O4溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快.
①某同学认为酸性KMnO4与H2C2O4溶液反应时反应速率明显加快,是因为反应放热使溶液温度升高.从影响化学反应速率的因素看,你的猜想还可能是催化剂(或锰离子的催化作用)的影响.
②若用实验证明你的猜想,除需要酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是b(填字母序号).
a.K2SO4 b.MnSO4 c.H2O d.MnO2
(2)实验二:探究酸的浓度对MnO2与H2O2反应速率的影响.
已知:MnO2+H2O2+2H+═Mn2++2H2O+O2↑,现取等量的MnO2和下表中的有关物质在相同温度下进行4组实验,分别记录收集等体积氧气所需的时间.
①上表中v1=5.0,v2=5.0.
②有同学提出实验Ⅰ不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是实验Ⅰ中MnO2作催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同.
③若实验测得t2>t3>t4,则可得出的实验结论是酸浓度越大,反应速率越快.
(1)实验一:已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑
△H<0,酸性KMnO4溶液和H2C2O4溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快.
①某同学认为酸性KMnO4与H2C2O4溶液反应时反应速率明显加快,是因为反应放热使溶液温度升高.从影响化学反应速率的因素看,你的猜想还可能是催化剂(或锰离子的催化作用)的影响.
②若用实验证明你的猜想,除需要酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是b(填字母序号).
a.K2SO4 b.MnSO4 c.H2O d.MnO2
(2)实验二:探究酸的浓度对MnO2与H2O2反应速率的影响.
已知:MnO2+H2O2+2H+═Mn2++2H2O+O2↑,现取等量的MnO2和下表中的有关物质在相同温度下进行4组实验,分别记录收集等体积氧气所需的时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | v1 | v2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | v3 |
| 水的体积/mL | 15 | 14.5 | v4 | 13.5 |
| 所需时间/min | t1 | t2 | t3 | t4 |
②有同学提出实验Ⅰ不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是实验Ⅰ中MnO2作催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同.
③若实验测得t2>t3>t4,则可得出的实验结论是酸浓度越大,反应速率越快.
10.生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
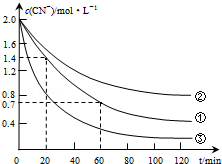
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
7.可逆反应2SO2+O2?2SO3达到平衡的标志是( )
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变
④恒容条件下压强保持不变
⑤一定体积下气体的密度保持不变
⑥v正(SO2)=2v逆(O2)
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变
④恒容条件下压强保持不变
⑤一定体积下气体的密度保持不变
⑥v正(SO2)=2v逆(O2)
| A. | .①②⑤ | B. | .①③④ | C. | .③④ | D. | ③④⑥ |
8.某无色透明溶液中,该溶液中一定能够大量共存的离子组是( )
| A. | K+、Na+、MnO4-、NO3- | B. | Fe3+、A13+、Cl-、HS- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | K+、Na+、SO42-、NO3- |