题目内容
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 28g乙烯所含共用电子对数目为2NA
B. 14g乙烯、丙烯、丁烯的混合气体中,所含原子数为3NA
C. 标准状况下,11.2L氟化氢所含分子数为0.5NA
D. 1.5g甲基所含电子数为NA
【答案】B
【解析】
A.每个乙烯分子中含有6对共用电子对。n(C2H4)= ![]() =1mol。因此含有共用电子对数目为6NA,选项A错误;
=1mol。因此含有共用电子对数目为6NA,选项A错误;
B.乙烯、丙烯、丁烯都属于烯烃,分子式通式为CnH2n,最简式为CH2,式量为14.所以14g的乙烯、丙烯、丁烯的混合气体共含有的原子数为3NA,选项B正确;
C、标准状况氟化氢不是气体,11.2L氟化氢物质的量不是0.5mol,选项C错误;
D.1个-CH3含有9个电子,所以1.5g甲基,即0.1 mol甲基(-CH3)所含的电子总数为0.9NA,选项D错误。
答案选B。

 阅读快车系列答案
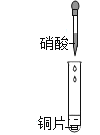
阅读快车系列答案【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
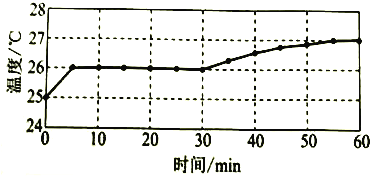
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
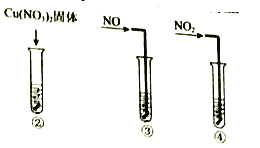
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
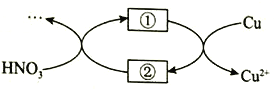
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
【题目】![]() 是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体
是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体![]() 流程如下:
流程如下:

下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入![]() 氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调
氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调![]() ,则溶液中
,则溶液中![]() _______________。(已知
_______________。(已知![]() ,
,![]() )
)
(2)滤液A的溶质主要是______________________。
(3)操作①的实验方法依次是_____________、_____________、过滤、洗涤、干燥,操作②的实验方法是_____________。