题目内容
(1)室温下在pH=12的NaCN溶液中,由水电离的c(OH-)为 mol?L-1.
(2)浓度为0.1mol?L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是 (填序号).
①NH4Cl ②NH4HSO4 ③NH3?H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-.
①则Na2A溶液显 性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”).
②若有0.1mo1?L-1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号).
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
B.c(Na+)>c(OH-)>c(HA-)>>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-)
D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
(4)在含有Cl-、Br-、I-的溶液中,已知其浓度均为0.1mol/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10-10、4.l×10-15、1.5×10-16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 .
②当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀 (当溶液中离子浓度小于1.0×10-5mol/L时,认为己沉淀完全,本空选填“是”或“否”).
(2)浓度为0.1mol?L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是
①NH4Cl ②NH4HSO4 ③NH3?H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-.
①则Na2A溶液显
②若有0.1mo1?L-1Na2A的溶液,其中各种离子浓度由大到小的顺序是:
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
B.c(Na+)>c(OH-)>c(HA-)>>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-)
D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
(4)在含有Cl-、Br-、I-的溶液中,已知其浓度均为0.1mol/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10-10、4.l×10-15、1.5×10-16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是
②当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀
考点:水的电离,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)NaCN溶液中氢氧根离子是水电离的,根据溶液的pH计算出溶液中氢氧根离子浓度;
(2)①铵根离子部分水解,②电离出氢离子抑制铵根离子水解,③氨水中部分电离出铵离子;④相互促进水解,据此进行比较铵离子浓度;
(3)①由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,NaHA溶液显示酸性;
②根据电荷守恒及酸根离子的水解分析判断;
(4)①根据溶度积常数计算各沉淀生成时所需银离子的浓度;
②计算出溴离子、碘离子浓度分别为1.0×10-5mol/L时银离子浓度,然后根据氯化银开始沉淀时银离子浓度进行比较,即可判断当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀.
(2)①铵根离子部分水解,②电离出氢离子抑制铵根离子水解,③氨水中部分电离出铵离子;④相互促进水解,据此进行比较铵离子浓度;
(3)①由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,NaHA溶液显示酸性;
②根据电荷守恒及酸根离子的水解分析判断;
(4)①根据溶度积常数计算各沉淀生成时所需银离子的浓度;
②计算出溴离子、碘离子浓度分别为1.0×10-5mol/L时银离子浓度,然后根据氯化银开始沉淀时银离子浓度进行比较,即可判断当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀.
解答:
解:(1)室温下在pH=12的NaCN溶液中,氢氧根离子浓度为:10-2mol/L,溶液中氢氧根离子为水电离的,由水电离的c(OH-)=10-2mol/L,
故答案为:10-2;
(2)①②④为铵盐,③为弱碱氨水,溶液中铵离子浓度③氨水的最小;而②中氢离子抑制了铵离子水解,溶液中的铵离子浓度最大,④中铵离子与醋酸根离子相互促进水解,铵离子浓度小于①②,所以相同浓度时c(NH4+)由大到小的顺序为:②>①>④>③,
故答案为:②>①>④>③;
(3)①Na2A为强碱弱酸盐,溶液中A2-离子水解,溶液显示碱性;NaHA溶液中,H2A第一步完全电离,HA-只电离,不会发生水解,所以NaHA溶液显示酸性,
故答案为:碱性;酸性;
②0.1mo1?L-1Na2A的溶液中,钠离子浓度最大,A2-离子部分水解生成HA-和OH-,OH-离子来自水的电离和A2-离子的水解,所以c(OH-)>c(HA-),因此溶液中离子浓度大小关系为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),
故答案为:A;
(4)①当生成AgBr沉淀时,所需银离子的浓度为:c(Ag+ )=
mol/L=4.1×10-14mol/l,
故答案为:4.1×10-14mo1/L;
②当生成AgCl沉淀时,所需银离子的浓度为:c(Ag+ )=
=
mol/L=1.6×10-9mol/l;
溶液中离子浓度小于1.0×10-5mol/L时,认为己沉淀完全;Br-沉淀完全时,溶液中Ag+浓度为:c(Ag+)=
mol/L=4.1×10-10mol/l<1.6×10-9mol/l,可见Br-已经完全沉淀;
I-离子完全沉淀时,溶液中银离子浓度为:c(Ag+)=
mol/L=1.5×10-11mol/l<1.6×10-9mol/l,可见I-已经完全沉淀;
故答案为:是.
故答案为:10-2;
(2)①②④为铵盐,③为弱碱氨水,溶液中铵离子浓度③氨水的最小;而②中氢离子抑制了铵离子水解,溶液中的铵离子浓度最大,④中铵离子与醋酸根离子相互促进水解,铵离子浓度小于①②,所以相同浓度时c(NH4+)由大到小的顺序为:②>①>④>③,
故答案为:②>①>④>③;
(3)①Na2A为强碱弱酸盐,溶液中A2-离子水解,溶液显示碱性;NaHA溶液中,H2A第一步完全电离,HA-只电离,不会发生水解,所以NaHA溶液显示酸性,
故答案为:碱性;酸性;
②0.1mo1?L-1Na2A的溶液中,钠离子浓度最大,A2-离子部分水解生成HA-和OH-,OH-离子来自水的电离和A2-离子的水解,所以c(OH-)>c(HA-),因此溶液中离子浓度大小关系为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),
故答案为:A;
(4)①当生成AgBr沉淀时,所需银离子的浓度为:c(Ag+ )=
| 4.1×10-15 |
| 0.1 |
故答案为:4.1×10-14mo1/L;
②当生成AgCl沉淀时,所需银离子的浓度为:c(Ag+ )=
| KSP |
| c(Cl-) |
| 1.6×10-10 |
| 0.1 |
溶液中离子浓度小于1.0×10-5mol/L时,认为己沉淀完全;Br-沉淀完全时,溶液中Ag+浓度为:c(Ag+)=
| 4.1×10-15 |
| 1×10-5 |
I-离子完全沉淀时,溶液中银离子浓度为:c(Ag+)=
| 1.5×10-16 |
| 1×10-5 |
故答案为:是.
点评:本题考查了水的电离、盐的水解原理及其应用、难溶电解质的溶解平衡及沉淀转化的本质、离子浓度大小比较,题目难度中等,试题涉及的知识点较多、题量稍大,注意掌握比较离子浓度大小的方法,明确盐的水解原理,掌握沉淀转化本质及其应用方法,(4)为本题难度和易错点.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Cl-+2Fe3+ |
| B、大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| D、为了除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理:Ca2++CO32-═CaCO3↓ |
背景材料:(1)2011年10月30日,湘潭市畜产品安全检测中心检测到市场上有假猪耳朵:黑心商贩使用化学物质(海藻酸钠、明矾、氧化钙等)制造,其中的明矾能引起恶心、呕吐、老年痴呆和慢性中毒,食用假猪耳朵对人体健康有害;
(2)2011年11月3日1点30分,中国自行研制的“神舟八号”飞船与“天宫一号”目标飞行器实现刚性连接,形成组合体,中国载人航天首次空间交会对接试验获得成功;
(3)“黄金有价玉无价”,北京奥运奖牌“金镶玉”中玉的成分主要为含水钙镁硅酸盐;
(4)人民网10月14日报道国家质检总局称阴极铜(粗铜经过电解后的产品)抽样合格率为100%.
以下说法中不正确的是( )
(2)2011年11月3日1点30分,中国自行研制的“神舟八号”飞船与“天宫一号”目标飞行器实现刚性连接,形成组合体,中国载人航天首次空间交会对接试验获得成功;
(3)“黄金有价玉无价”,北京奥运奖牌“金镶玉”中玉的成分主要为含水钙镁硅酸盐;
(4)人民网10月14日报道国家质检总局称阴极铜(粗铜经过电解后的产品)抽样合格率为100%.
以下说法中不正确的是( )
| A、明矾可用来净水却不能降低水的硬度,其净水原理是:KAl(SO4)2═K++Al3++SO42-;Al3++3H2O?Al(OH)3(胶体)+3H+ |
| B、在粗铜的电解精炼中,粗铜为电解池的阴极,纯铜为电解池的阳极 |
| C、某硅酸盐Ca2Mg5Si8O22(OH)2可用氧化物表示为2CaO?5MgO?8SiO2?H2O |
| D、若火箭推进器中发生:H2N-N(CH3)2+2N2O4═3N2+2CO2+4H2O反应.则每生成3mol 氮气,转移电子的物质的量为16mol |
在密闭容器中,反应X2(g)+2Y2(g)?2XY2(g)△H<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是( )
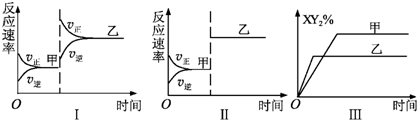

| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
| A、柠檬酸的电离会抑制碳酸的电离 |
| B、该碳酸饮料中水的电离受到抑制 |
| C、常温下,该碳酸饮料中KW的值大于纯水中KW的值 |
| D、打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.
