题目内容
 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( )
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( )| A、a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B、a点对应的Ksp不等于c点对应的Ksp |
| C、b点将有沉淀生成 |
| D、向d点溶液中加入适量CaCl2固体可以变到c点 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、处于曲线上的点为饱和溶液的平衡状态;
B、Ksp与温度有关,a和c的Ksp相等;
C、依据图示读数判断是否有沉淀生成即可;
D、d点为不饱和状态,与c比较钙离子浓度较小.
B、Ksp与温度有关,a和c的Ksp相等;
C、依据图示读数判断是否有沉淀生成即可;
D、d点为不饱和状态,与c比较钙离子浓度较小.
解答:
解:A、处于曲线上的点为饱和溶液的平衡状态,故A正确;
B、a、c两点温度相同,Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故B错误;
C、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,故C正确;
D、d点为不饱和状态,钙离子浓度较小,如加入适量CaCl2固体,钙离子浓度增大,此时硫酸根离子浓度不变,则可以变到c点,故D正确.
故选B.
B、a、c两点温度相同,Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故B错误;
C、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,故C正确;
D、d点为不饱和状态,钙离子浓度较小,如加入适量CaCl2固体,钙离子浓度增大,此时硫酸根离子浓度不变,则可以变到c点,故D正确.
故选B.
点评:本题考查了沉淀溶解平衡的应用,图象分析应用,溶度积计算分析,平衡移动方向的判断,关键是计算混合溶液中钙离子浓度和硫酸根离子浓度,题目难度中等.

练习册系列答案
相关题目
欲使0.1mol?L-1 的NaHSO3溶液中c(H+)、c(SO32-)都减少,其方法是( )
| A、加入过量CaO(s) |
| B、加入少量NaOH(s) |
| C、通入过量HCl(g) |
| D、加入少量H2O2 |
下列离子方程式正确的是( )
| A、铝溶于NaOH溶液:Al+2OH-=AlO2-+H2↑ |
| B、过量CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |
| C、钠与水反应:2Na+2H2O=2Na++2OHˉ+H2↑ |
| D、稀硫酸中滴加氢氧化钡溶液:H++OH-=H2O |
元素的存在形态有( )
| A、单质和化合物 |
| B、溶液、浊液、胶体 |
| C、化合态和游离态 |
| D、纯净物和混合物 |
相同温度,体积均为0.5L的两个恒容容器中发生可逆反应:A(g)+3B(g)═2C(g)△H=-92.6kJ?mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示 下列叙述不正确的是( )
| 容器编号 | 各物质物质量/ | 达到平衡时体系能量变化 | ||
| A | B | C | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.3 | 0.9 | 1.4 | |
| A、达平衡时,两个容器中C的物质的量浓度均为1.0mol?L-1 |
| B、容器①达平衡A转化率是50% |
| C、容器②中达平衡时吸收的热量为18.52kJ |
| D、若起始容器中A、B、C各为0.5mol,则达平衡前υ(正)<υ(逆) |


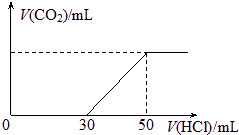 标况下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.(假设生成的CO2全部逸出).求:
标况下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.(假设生成的CO2全部逸出).求: