题目内容
7.0.12NA个SO3的物质的量是0.12mol,质量是9.6g,其中O是0.36mol,质量是5.76g.分析 根据n=$\frac{N}{{N}_{A}}$计算SO3的物质的量,根据m=nM计算SO3的质量;每个SO3分子中含有3个O原子,则O原子物质的量是SO3的物质的量3倍,根据m=nM计算O原子质量.
解答 解:n(SO3)=$\frac{N}{{N}_{A}}$=$\frac{0.12{N}_{A}}{{N}_{A}/mol}$=0.12mol,m(SO3)=nM=0.12mol×80g/mol=9.6g;每个SO3分子中含有3个O原子,则n(O)=3n(SO3)=3×0.12mol=0.36mol,m(O)=nM=0.36mol×16g/mol=5.76g,
故答案为:0.12;9.6;0.36;5.76.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量关系是解本题关键,注意化学式中各元素原子物质的量之比等于其系数之比,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
17.已知王水由盐酸和硝酸组成,c(Cl-)+c(NO3-)=18mol•L-1.为了测定王水的组成,取100mL该王水加水稀释至250mL,取25mL稀溶液加入足量的硝酸银溶液,过滤、洗涤、烘干、称重,得固体质量mg.则该王水中硝酸的物质的量浓度(mol•L-1)为( )
| A. | $\frac{10m}{143.5}$ | B. | $\frac{100m}{143.5}$ | C. | 18-$\frac{100m}{143.5}$ | D. | 18-$\frac{10m}{143.5}$ |
15.含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中Cl-为1.5mol,K+为1.0mol,Na+为0.5mol,Mg2+为0.5mol,则SO42-的物质的量为( )
| A. | 0.15 mol | B. | 0.25 mol | C. | 0.5 mol | D. | 1 mol |
12.由K2SO4、Al2(SO4)?3、H2SO4及KAl(SO4)?2•12H2O组成的混合溶液,测得c(H+)?=0.3mol•L-1,c(Al3+)=0.3mol•L-1,c(SO42-)?=0.8mol•L-1,则c(K+)为( )
| A. | 0.15mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
2.单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.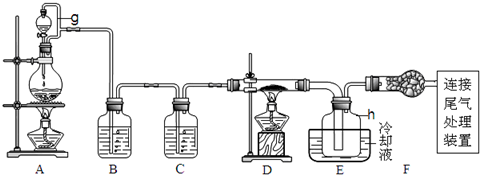
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集.
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+.
①写出用KMnO4滴定Fe2+的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前是否要滴加指示剂?否(填“是”或“否”),判断滴定终点的方法是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色.
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响偏低(填“偏高”、“偏低”、或“无影响”)

查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集.
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+.
①写出用KMnO4滴定Fe2+的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前是否要滴加指示剂?否(填“是”或“否”),判断滴定终点的方法是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色.
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响偏低(填“偏高”、“偏低”、或“无影响”)

 .
.
 .
.