题目内容
下列图示与对应的叙述一定正确的是( )
A、 所示反应:X(g)+Y(g)═2Z(g),b的压强一定比a大 所示反应:X(g)+Y(g)═2Z(g),b的压强一定比a大 |
B、 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 |
C、 表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化 表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化 |
D、 表示纯碱溶液受热时氢氧根浓度随温度的变化 |
考点:转化率随温度、压强的变化曲线,化学反应的能量变化规律,化学方程式的有关计算,盐类水解的原理
专题:
分析:A、b线可以表示催化剂作用;
B、反应物能量高于生成物,反应放热,催化剂降低反应活化能加快反应速率;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,反应为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,根据反应的离子方程式判断;
D.纯碱溶液受热时水解程度增大.
B、反应物能量高于生成物,反应放热,催化剂降低反应活化能加快反应速率;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,反应为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,根据反应的离子方程式判断;
D.纯碱溶液受热时水解程度增大.
解答:
解:A、X(g)+Y(g)?2Z(g),反应前后气体体积不变,b曲线可以表示的是增大压强的变化,增大压强速率增大,平衡不动,也可以是加入催化剂加快反应速率缩短达到平衡的时间,平衡不动,故A错误;
B、图象中依据能量高低分析,反应是放热反应;b线是降低了反应的活化能,加快了反应速率,缩短了达到平衡的时间,但不改变平衡,属于为加入了催化剂,故B正确;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,反应为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,则一开始就有沉淀生成,故C错误;
D.纯碱溶液受热时水解程度增大,氢氧根离子浓度增大,故D错误.
故选B.
B、图象中依据能量高低分析,反应是放热反应;b线是降低了反应的活化能,加快了反应速率,缩短了达到平衡的时间,但不改变平衡,属于为加入了催化剂,故B正确;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,反应为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,则一开始就有沉淀生成,故C错误;
D.纯碱溶液受热时水解程度增大,氢氧根离子浓度增大,故D错误.
故选B.
点评:本题考查较为综合,以图象的形成考查化学平衡移动问题以及元素化合物知识,题目难度中等,易错点为C,注意把握反应的原理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
汽车尾气净化中的一个反应如下:NO(g)+CO(g)?
N2(g)+CO2 (g)△H=-373.4kJ.mol-1若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( )
| 1 |
| 2 |
| A、其它条件不变,加入催化剂,△H变大 |
| B、及时除去二氧化碳,正反应速率加快 |
| C、降低温度,可提高反应物的转化率 |
| D、若气体的密度保持不变,说明平衡不发生移动 |
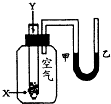 某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )
某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )①该反应为放热反应
②反应物的总能量比生成物的总能量高
③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来.
| A、①②③ | B、①③ | C、②③ | D、③ |
下列说法正确的是( )
| A、乙醇分子中的氢原子均可被金属钠置换 |
| B、烃分子中的氢原子被羟基取代后的衍生物都属于醇 |
| C、甲醇是最简单的醇,它不能发生消去反应生成烯烃 |
| D、某一元醇在浓硫酸存在下加热到170℃可以生成丙烯,该一元醇一定是1-丙醇 |
相对分子质量均为88的饱和一元醇和饱和一元羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)( )
| A、8种 | B、12种 |
| C、16种 | D、18种 |




 如图所示,烧杯中都盛有稀硫酸:
如图所示,烧杯中都盛有稀硫酸: