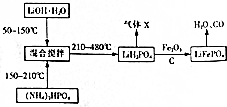
题目内容
11. 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98 kJ•mol-1.
(1)某温度下该反应的平衡常数K=$\frac{10}{3}$,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)>v(逆)(填“<”“>”或“=”).
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为60%.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是AC(填字母).
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
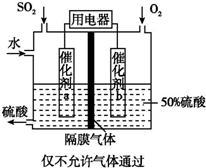
(4)若以如图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为O2+4e-+4H+=2H2O.
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为16:29.
分析 (1)某温度下该反应的平衡常数K=$\frac{10}{3}$,计算Qc与K比较,判断反应速率关系;
(2)2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始 2 1 0
转化2x x 2x
平衡2-2x 1-x 2x
由$\frac{2L}{1.6L}=\frac{3mol}{2-2x+1-x+2x}$,解得x=0.12mol,以此计算;
(3)能使SO2(g)平衡浓度比原来减小,则化学平衡正向移动;
(4)通入O2电极为正极,得到电子;
(5)硫酸溶液的浓度应维持不变,可知生成硫酸溶液中硫酸的质量为98g,则水的质量为98g,二氧化硫与水反应时消耗1mol水,以此计算.
解答 解:(1)某温度下该反应的平衡常数K=$\frac{10}{3}$,因为浓度商Qc=$\frac{0.03mol/L}{0.03mol/L×(0.16mol/L)^{\frac{1}{2}}}$=2.5>K,所以化学反应正向进行,即v(正)>v(逆),故答案为:>;
(2)2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始 2 1 0
转化2x x 2x
平衡2-2x 1-x 2x
由$\frac{2L}{1.6L}=\frac{3mol}{2-2x+1-x+2x}$,解得x=0.6mol,
可知参与反应的SO2为1.2 mol,所以SO2的转化率α=$\frac{1.2mol}{2mol}$×100%=60%,
故答案为:60%;
(3)A.保持温度和容器体积不变,O2的浓度增大,平衡正向移动,SO2的浓度减小,故A正确;
B.保持温度和容器内压强不变,充入1 mol SO3,新的平衡与原平衡等效,SO2的浓度不变,故B错误;
C.降低温度,平衡向放热的方向移动,而正反应为放热,所以平衡正向移动,SO2的浓度减小,故C正确;
D.移动活塞压缩气体,SO2的浓度瞬间增大,之后平衡向气体体积减小的方向移动,即向正反应方向移动,SO2的浓度减小,再次到达平衡时SO2的浓度仍比原来大,故D错误;
故答案为:AC;
(4)SO2被氧化为硫酸,则通入O2的电极是正极,发生得电子还原反应,结合电解质溶液显酸性,则电极反应式是O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(5)硫酸溶液的浓度应维持不变,可知生成硫酸溶液中硫酸的质量为98g,则水的质量为98g,二氧化硫与水反应时消耗1mol水,则1 mol SO2转化为50%硫酸所需水的质量为18g/mol×(1mol+$\frac{98g}{18g/mol}$)=116 g,故SO2与H2O质量比为32:116=16:29,故答案为:16:29.
点评 本题考查化学平衡移动、计算及电解池原理等,为高频考点,把握相关化学反应原理知识为解答的关键,侧重分析与应用能力的考查,题目难度中等.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案| 操作 | 现象 | |
| A | 加入NaOH溶液 | 有红褐色沉淀 |
| B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| C | 加入酸性KMnO4溶液 | 紫色褪去 |
| D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
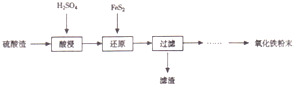
注:硫废渣(主要含Fe2O3、SiO2、Al2O3、MgO、等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②抑制Fe3+的水解
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+
(3 )为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量,实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2以二苯胺磺酸钠为指示剂,用K2Cr2O3标准溶液滴定,有关反应方程如下:
2Fe3++Sn2++6Cl-═2Fe2++SnCl42-
Sn2++4Cl-+2HgCl2═SnCl42-+Hg2Cl2↓
6Fe2++Cr2O32-+14H+═6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量偏低(填“偏高”、“偏低”、“不变”,下同)
②若不加HgCl2,则测定的Fe3+量偏高
(4)①可选用KSCN或
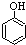 (填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
(填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O②已知部分阳离子以氢氧化物形成沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | A1(0H)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
第一步:氧化向溶液中加入过量的酸性高锰酸钾溶液,搅拌(填写具体操作)
笫二步:沉淀滴加NaOH溶液,调节溶液为pH为3.2~3.8(填写具体操作)
第三步:分离,洗涤;
第四步:烘干.研磨.
| A. | 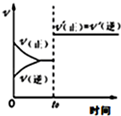 反应CO+NO2?CO2+NO达平衡后,增大压强时反应速率随时间的变化 | |
| B. | 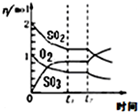 反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 | |
| C. | 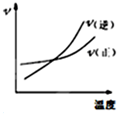 反应N2+3H 2?2NH3△H<0在恒容的容器中,反应速率与温度的关系 | |
| D. | 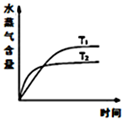 反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化 |
| A. | O3 | B. | SO2 | C. | CO | D. | N2 |
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧产生苍白色的火焰 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 去黄豆粒大小的钠与水反应,钠熔化成闪亮的小球,浮在水面,不断游动,嘶嘶作响,最后消失 | 钠熔点低、密度比水小,放热,具有强还原性 |
| A. | A | B. | B | C. | C | D. | D |
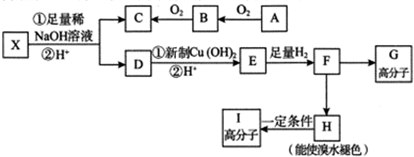
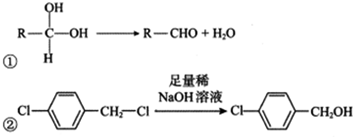
 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;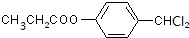 +4NaOH$→_{△}^{水}$CH3CH2COONa+
+4NaOH$→_{△}^{水}$CH3CH2COONa+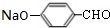 +2H2O+2NaCl;
+2H2O+2NaCl; .
.