题目内容
7.分别放在0.1mol•L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是( )
| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
分析 电化学腐蚀较化学腐蚀快,作原电池负极和电解池阳极的金属加速被腐蚀,作原电池正极和电解池阴极的金属被保护,金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极.
解答 解:金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极,
①中锌发生化学腐蚀,②中锌作正极加速被保护,③中锌作负极加速被腐蚀,④中锌作阴极被保护,
所以锌被腐蚀快慢顺序是③>①>②>④,
故选B.
点评 本题以金属的腐蚀快慢为载体考查了原电池和电解池原理,明确作哪种电极加速被腐蚀、作哪种电极被保护是解本题关键,知道金属被腐蚀快慢的规律,难度不大.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
15.下列关于化学反应的描述中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量 | |
| C. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ/mol | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H=akJ/mol,2C(s)+O2(g)=2CO(g)△H=bkJ/mol,则b>a |
2.下列气体所含分子数最少的是( )
| A. | 9.0g C2H6 | B. | 标准状况下5.6L 空气 | ||
| C. | 0.75mol N2 | D. | 3.01×1023 个臭氧分子 |
19.一定条件下,在2L密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,测得1min内,H2的物质的量由3mol减少到1.2mol,则1min内NH3的化学反应速率为( )
| A. | 0.6 mol•L-1•min-1 | B. | 0.9 mol•L-1•min-1 | ||
| C. | 1.2 mol•L-1•min-1 | D. | 1.8 mol•L-1•min-1 |
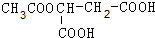 +H2O.
+H2O.
 已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,
已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族, .
.