题目内容
1. 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )| A. | a点表示反应处于平衡状态 | |
| B. | 25 min末,若增大压强,化学平衡常数增大 | |
| C. | 25 min末,若升高温度,NO2的体积分数减小 | |
| D. | 10min内用N2O4表示的平均速率为0.02mol•L-1•min-1 |
分析 A、a点以后物质的浓度还在继续发生变化,在10min时浓度不变,到达平衡;
B、化学平衡常数只受温度影响,温度不变,平衡常数不变;
C、由图可知平衡时,浓度降低的物质的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,浓度增大的物质的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,根据浓度变化量之比等于化学计量数之比,二者浓度变化为0.2mol/L:0.4mol/L=1:2,浓度降低的物质为N2O4,浓度增大的物质为NO2,故反应为N2O4(g)?2NO2(g)△H>0,该反应正反应是吸热反应,升高温度平衡向正反应移动,据此判断;
D、由C中分析可知,平衡时N2O4的浓度变化量为0.2mol/L,根据v=$\frac{△c}{△t}$计算v(N2O4).
解答 解:A、a点以后物质的浓度还在继续发生变化,在10min时浓度不变,到达平衡,故a点未到达平衡,故A错误;
B、化学平衡常数只受温度影响,温度不变,平衡常数不变,增大压强化学平衡常数不变,故B错误;
C、由图可知平衡时,浓度降低的物质的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,浓度增大的物质的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,根据浓度变化量之比等于化学计量数之比,二者浓度变化为0.2mol/L:0.4mol/L=1:2,浓度降低的物质为N2O4,浓度增大的物质为NO2,故反应为N2O4(g)?2NO2(g)△H>0,该反应正反应是吸热反应,升高温度平衡向正反应移动,NO2的体积分数增大,故C错误;
D、由C中分析可知,平衡时N2O4的浓度变化量为0.2mol/L,v(N2O4)=$\frac{0.2mol/L}{10min}$=0.02mol•L-1•min-1,故D正确;
故选D.
点评 本题考查物质的量浓度随时间变化曲线、化学平衡的有关计算等,难度中等,判断发生的反应是解题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | (100-$\frac{7A}{6}$)% | B. | 10A% | C. | ($\frac{A}{6}$)% | D. | 6A% |
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氢气含有的分子数为NA | |
| C. | 在常温常压下,32 g氧气含原子数为NA | |
| D. | 标准状况下,1mol水的体积约为22.4L |
| A. | 1mol固态物质或液态物质的体积主要决定于构成这种物质的粒子的大小 | |
| B. | 在相同温度和压强下,任何气体粒子之间的距离可看成相等的 | |
| C. | 某同学用容量瓶配制溶液加水时不慎超出刻度线必须重新配制 | |
| D. | 为与容量瓶的精度相匹配称量固体质量时应用托盘天平 |
| A. | 常温下,用pH试纸测得某新制氯水的pH值为9 | |
| B. | 用标准盐酸溶液滴定一定体积的待测NaOH溶液时,用石蕊做指示剂 | |
| C. | 用碱式滴定管量取高锰酸钾溶液5.10 mL | |
| D. | 用10 mL的量筒量取8.5 mL浓硫酸 |
| A. | 由于Al2O3熔点比Al高,所以在酒精灯上加热铝箔时,铝熔化但不滴落 | |
| B. | 铁丝不论在空气中还是纯氧中都不会燃烧 | |
| C. | 钠与氧气反应时,产物是由反应条件决定 | |
| D. | 金属单质与非金属单质发生反应时,被氧化的一定是金属单质 |
| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
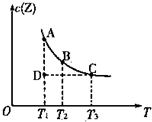 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为:
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为: