题目内容
下列反应的离子方程式正确的是( )
A、硫酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-
| ||||
B、将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O
| ||||
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | ||||
| D、苯酚钠溶液中通入少量的CO2:2C2H5O-+CO2+H2O→2C2H5OH+CO32- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.漏写氢离子与碱的反应;
B.铁离子水解生成胶体;
C.发生氧化还原反应生成碘化亚铁、碘和水;
D.反应生成苯酚和碳酸氢钠.
B.铁离子水解生成胶体;
C.发生氧化还原反应生成碘化亚铁、碘和水;
D.反应生成苯酚和碳酸氢钠.
解答:
解:A.硫酸氢铵溶液与足量氢氧化钠溶液反应的离子反应为H++NH4++2OH-
NH3↑+2H2O,故A错误;
B.将饱和FeCl3溶液滴入沸水中制备胶体的离子反应为Fe3++3H2O
Fe(OH)3(胶体)+3H+,故B正确;
C.Fe2O3固体溶于过量氢碘酸溶液中的离子反应为Fe2O3+2I-+6H+═2Fe2++I2+3H2O,故C错误;
D.苯酚钠溶液中通入少量的CO2的离子反应为C2H5O-+CO2+H2O→C2H5OH+HCO3-,故D错误;
故选B.
| ||
B.将饱和FeCl3溶液滴入沸水中制备胶体的离子反应为Fe3++3H2O
| ||
C.Fe2O3固体溶于过量氢碘酸溶液中的离子反应为Fe2O3+2I-+6H+═2Fe2++I2+3H2O,故C错误;
D.苯酚钠溶液中通入少量的CO2的离子反应为C2H5O-+CO2+H2O→C2H5OH+HCO3-,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重水解反应、氧化还原反应、与量有关的离子反应的考查,题目难度不大,选项C为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
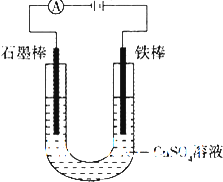 如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )
如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )| A、转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C、电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D、若将石墨棒换成铜棒,可实现铁制品上镀铜 |
下列对应关系不正确的是( )
| A、醋、味精--调味品 |
| B、酒精、汽油--易燃液体 |
| C、Na+、Fe3+--人体所需微量元素 |
| D、废塑料瓶、铝制易拉罐--可回收垃圾 |
下列说法正确的是( )
| A、钙和氮均为人体所需的微量元素 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、油脂和蛋白质均属于高分子化合物 |
| D、明矾与水作用能生成有吸附性的物质 |
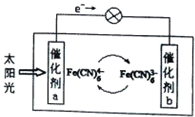 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
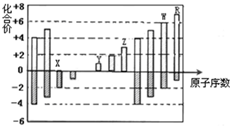 如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:Z>Y>X |
| B、气态氢化物的还原性:W>R |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、含Z的盐溶液一定显示酸性 |
下列涉及有机物的说法正确的是( )
| A、甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 |
| B、石油和植物油都是混合物,且属于不同类的有机物 |
| C、乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应 |
| D、纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |