题目内容
【题目】“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
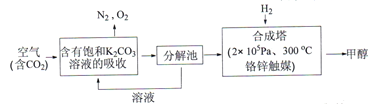
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
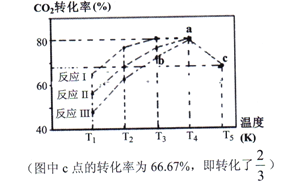
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
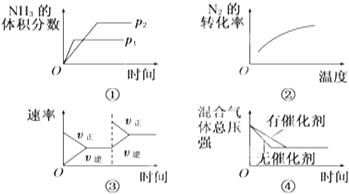
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。

(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)

a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
【答案】 CO2(g)+ 3H2(g) ![]() H2O(g)+ CH3OH(g) ΔH=- 53.7kJ/mol 反应I > K=16/3(L/mol)2 减小 bd 阳 2HSO3-+2e-+2H+= S2O42-+2H2O SO2在a极发生氧化反应,电极反应式: SO2-2e-+2H2O=4H++SO42-,H+通过阳离子交换膜进入b极室
H2O(g)+ CH3OH(g) ΔH=- 53.7kJ/mol 反应I > K=16/3(L/mol)2 减小 bd 阳 2HSO3-+2e-+2H+= S2O42-+2H2O SO2在a极发生氧化反应,电极反应式: SO2-2e-+2H2O=4H++SO42-,H+通过阳离子交换膜进入b极室
【解析】I. (1). 1mol二氧化碳反应时放出的热量为:5370kJ×![]() =53.7kJ,则该反应的热化学方程式为:CO2(g)+ 3H2(g)
=53.7kJ,则该反应的热化学方程式为:CO2(g)+ 3H2(g) ![]() H2O(g)+ CH3OH(g) ΔH=-53.7kJ/mol,故答案为:CO2(g)+ 3H2(g)
H2O(g)+ CH3OH(g) ΔH=-53.7kJ/mol,故答案为:CO2(g)+ 3H2(g) ![]() H2O(g)+ CH3OH(g) ΔH=-53.7kJ/mol;
H2O(g)+ CH3OH(g) ΔH=-53.7kJ/mol;
(2). ①. 据图可知,反应I在较低温度T3时CO2就达到了80%的转化率,则催化剂效果最佳的是反应I,故答案为:反应I;
②. T3时的b点,反应尚未达到最大限度,则v (正)>v (逆),故答案为:>;
③. c点时,根据三段式法有:
CO2(g)+ 3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始浓度(mol/L) 0.5 1.5 0 0
转化浓度(mol/L)0.5×![]() 1.5×
1.5×![]() 0.5×
0.5×![]() 0.5×
0.5×![]()
平衡浓度(mol/L)0.5×![]() 1.5×
1.5×![]() 0.5×
0.5×![]() 0.5×
0.5×![]()
在温度为T5时,该反应的平衡常数K=![]() =
=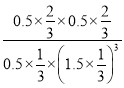 =
=![]() (L/mol)2,故答案为:K=
(L/mol)2,故答案为:K=![]() (L/mol)2;
(L/mol)2;
II. (3). 该反应的ΔH<0,为放热反应,温度升高,平衡逆向移动,K值减小,故答案为:减小;
(4). a. t1时刻正反应速率最大,之后随反应的进行正反应速率减小,说明t1时刻未达到平衡状态,故a错误;b. 该反应正向为气体减少的反应,随着反应的进行,体逐渐减少,压强逐渐减小,t1时刻压强不再改变,说明反应达到了平衡状态,故b正确;c. t1时刻时CO2和CO的物质的量相等,但t1时刻后,二者的物质的量发生变化,说明t1时刻未达到平衡状态,故c错误;d. 随着反应的进行,NO质量分数逐渐减小,t1时刻不再改变,说明反应达到平衡状态,故d正确;答案为:bd;
(5). 因阳极发生氧化反应,则阳极上发生的是二氧化硫被氧化为硫酸根离子的反应,所以a为阳极,阳极上发生的电极反应式为:SO2-2e-+2H2O=4H++SO42-,b为阴极,在阴极上,亚硫酸氢根离子得电子生成S2O42-,电极反应式为:2HSO3-+2e-+2H+= S2O42-+2H2O,根据上述分析可知,SO2在a极发生氧化反应,电极反应式为SO2-2e-+2H2O=4H++SO42-,H+通过阳离子交换膜进入b极室参与阴极反应,故答案为: 阳;2HSO3-+2e-+2H+= S2O42-+2H2O;SO2在a极发生氧化反应,电极反应式:SO2-2e-+2H2O=4H++ SO42-,H+通过阳离子交换膜进入b极室。

 名校课堂系列答案
名校课堂系列答案