题目内容
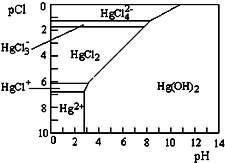 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)].
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]. (1)正常海水(Cl-的浓度大于0.1mo/L)中汞元素的主要存在形态是
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是
(3)处理含汞废水的方法很多.下面是常用的两种方法,汞的回收率很高.
①置换法:用废铜屑处理含Hg2+的废水.反应的离子方程式为
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀.已知:
Ksp(HgS)=1.6×10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)=
考点:难溶电解质的溶解平衡及沉淀转化的本质,离子方程式的有关计算,pH的简单计算
专题:
分析:(1)据二价汞主要存在形态与Cl-、OH-的浓度关系图分析,在pCl=1和pCl=3时二价汞的主要存在形式;
(2)Hg(NO3)2是强酸弱碱盐,在水溶液中能够水解,加酸可以抑制其水解;
(3)①铜比汞活泼,能够从汞的盐溶液中将汞置换出来;
②据Ksp(HgS)=1.6×10-52和c(S2-)=1×10-5mol/L计算c(Hg2+).
(2)Hg(NO3)2是强酸弱碱盐,在水溶液中能够水解,加酸可以抑制其水解;
(3)①铜比汞活泼,能够从汞的盐溶液中将汞置换出来;
②据Ksp(HgS)=1.6×10-52和c(S2-)=1×10-5mol/L计算c(Hg2+).
解答:
解:(1)据二价汞主要存在形态与Cl-、OH-的浓度关系图分析,在pCl=1和pCl=3时二价汞的主要存在形式分别为:HgC142-、HgC12,故答案为:HgC142-; HgC12;
(2)Hg(NO3)2是强酸弱碱盐,在水溶液中能够水解,水解的离子方程式为:Hg2++2H2O?Hg(OH)2+2H+,增大氢离子浓度,可以抑制其水解,所以配制硝酸汞溶液时,将硝酸汞溶液稀硝酸中,再加水稀释到所需浓度,故答案为:Hg2++2H2O?Hg(OH)2+2H+;在硝酸中配制;
(3)①铜比汞活泼,能够从汞的盐溶液中将汞置换出来,反应的离子方程式为:Cu+Hg2+?Cu2++Hg,故答案为:Cu+Hg2+?Cu2++Hg;
①Ksp(HgS)=[Hg2+]?[S2-]=[Hg2+]×1×10-5=1.6×10-52,所以c(Hg2+)=
=1.6×10-47mol/L,故答案为:1.6×10-47mol/L.
(2)Hg(NO3)2是强酸弱碱盐,在水溶液中能够水解,水解的离子方程式为:Hg2++2H2O?Hg(OH)2+2H+,增大氢离子浓度,可以抑制其水解,所以配制硝酸汞溶液时,将硝酸汞溶液稀硝酸中,再加水稀释到所需浓度,故答案为:Hg2++2H2O?Hg(OH)2+2H+;在硝酸中配制;
(3)①铜比汞活泼,能够从汞的盐溶液中将汞置换出来,反应的离子方程式为:Cu+Hg2+?Cu2++Hg,故答案为:Cu+Hg2+?Cu2++Hg;
①Ksp(HgS)=[Hg2+]?[S2-]=[Hg2+]×1×10-5=1.6×10-52,所以c(Hg2+)=
| 1.6×10-52 |
| 1×10-5 |
点评:本题考查了图象分析、盐类水解及水解平衡的移动、关于沉淀溶度积的计算,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、能使品红褪色的不一定是SO2 |
| B、因为SO2有漂白性,所以它能使品红溶液、溴水、高锰酸钾褪色 |
| C、漂白粉、SO2、Na2O2、活性炭都使能红墨水褪色,其原理相同 |
| D、为了增强漂白性,将SO2和Cl2这两种气体同时作用于潮湿的有色布条使其褪色 |
实验室合成三氧化硫装置如图所示,则以下说法中错误的是( )


| A、装置甲的作用是混合气体、干燥等 |
| B、所需的催化剂为铁触媒 |
| C、乙处导出的气体是SO3、SO2、O2 |
| D、虽SO3极易溶于水,但生成的三氧化硫不宜直接通入水中吸收 |
环己烷有两种空间立体结构:船式环己烷( )和椅式环己烷(
)和椅式环己烷( ).如果环己烷分子中有两个不同碳上的氢原子被氯原子取代,考虑环己烷的船式和椅式结构,则二氯环己烷应有同分异构体( )
).如果环己烷分子中有两个不同碳上的氢原子被氯原子取代,考虑环己烷的船式和椅式结构,则二氯环己烷应有同分异构体( )
 )和椅式环己烷(
)和椅式环己烷( ).如果环己烷分子中有两个不同碳上的氢原子被氯原子取代,考虑环己烷的船式和椅式结构,则二氯环己烷应有同分异构体( )
).如果环己烷分子中有两个不同碳上的氢原子被氯原子取代,考虑环己烷的船式和椅式结构,则二氯环己烷应有同分异构体( )| A、12种 | B、6种 |
| C、18种 | D、9种 |
已知K2Cr2O7+Cu+(NH4)2CO3→[Cu(NH3)4]CO3+[Cu(NH3)4](HCO3)2+KHCO3+[Cr(NH3)6](HCO3)3+H2O,若配平后,K2Cr2O7的系数为a,则(NH4)2CO3的系数为( )
| A、8a | B、10a |
| C、12a | D、14a |
有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使酸性KMnO4溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )
| A、CH≡C-CH3 |
B、 |
| C、CH2═CHCH3 |
D、 |