题目内容
硫酸铝、硫酸钾、明矾三种物质组成的混合溶液中,当SO42-的浓度为0.20mol/L时,加入等体积的0.20mol/L的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么反应后的溶液中K+的浓度是( )
| A、0.20mol/L |
| B、0.25mol/L |
| C、0.225mol/L |
| D、0.45mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积等SO42-浓度的KOH溶液时,生成的沉淀恰好完全溶解,发生总反应为:Al3++4OH-=AlO2-+2H2O,根据方程式可知,原溶液中c(Al3+)=
c(OH-),根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42),据此计算原溶液中K+离子的浓度,溶液中钾离子包括KOH含有的与原溶液中的钾离子,令溶液体积都是1L,根据n=cV计算混合后溶液中n(K+),进而计算混合后K+的浓度.
| 1 |
| 4 |
解答:
解:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积等SO42-浓度 KOH溶液时,生成的沉淀恰好完全溶解,发生总反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=
n(OH-),所以原溶液中c(Al3+)=
c(OH-)=
×0.2mol/L=0.05mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以原溶液中c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L,
令混合溶液与氢氧化钾溶液的体积都是1L,则混合后溶液中n(K+)=1L×(0.25mol/L+0.2mol/L)=0.45mol,故反应后的溶液中K+的浓度为
=0.225mol/L,
故选:C.
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
令混合溶液与氢氧化钾溶液的体积都是1L,则混合后溶液中n(K+)=1L×(0.25mol/L+0.2mol/L)=0.45mol,故反应后的溶液中K+的浓度为
| 0.45mol |
| 1L+1L |
故选:C.
点评:本题考查有关混合物的计算,题目难度不大,根据电荷守恒计算原混合溶液中钾离子浓度是关键.

练习册系列答案
相关题目
对于常温下pH=2盐酸,叙述正确的是( )
| A、与pH=2的CH3COOH溶液中c(H+)相同 |
| B、与等体积pH=12的氨水混合后所得溶液pH=7 |
| C、与等体积pH=12的氢氧化钡溶液混合后所得溶液pH=7 |
| D、与等体积0.01mol?L-1 CH3COONa溶液混合后所得溶液中c(Cl-)=c(CH3C00-) |
下列有关化学用语表示正确的是( )
| A、乙酸的结构简式:C2H4O2 |
| B、中子数为20的氯原子:2017Cl |
C、S2-的结构示意图: |
D、NH3 的电子式: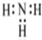 |
下列说法错误的是( )
| A、0.3 mol硝酸 |
| B、1.5 mol氧气 |
| C、1 mol氮 |
| D、0.5 mol氖 |
设NA表示阿伏加德罗常数,则下列说法中正确的是( )
| A、含Fe(OH)3为1mol的氢氧化铁胶体分散系中,分散质的粒子个数为NA |
| B、0.5mol 钠与氯气发生反应转移的电子数为NA |
| C、同温同压下,分子数相同的氧气和氮气所占体积也一定相同 |
| D、在标准状况下,4.48L CCl4中所含的原子总数为NA |
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构.下列说法不正确的是( )
| A、原子最外层电子数:Z>X>Y |
| B、氢化物的稳定性:Z>X |
| C、离子半径:X2->Y+>Z- |
| D、原子序数:X>Y>Z |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A、利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |
| B、因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| C、从海水中可得到NaCl,电解熔融NaCl或NaCl的水溶液都可制得Cl2 |
| D、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 |
某反应2A+3B═2C+D在四种不同条件下的反应速率如下,则反应速率最快的是( )
| A、v(A)=0.5 mol/(L?min) |
| B、v(B)=0.6 mo1(L?min) |
| C、v(C)=0.35 mol/(L?min) |
| D、v(D)=0.4 mol/(L?min) |