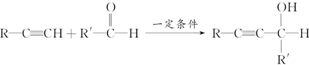题目内容
5.有机物A含有C、H、O三种元素,在同温同压下,A蒸气对乙醇蒸气的相对密度是2.现将13.8gA完全燃烧后进行测定.若将燃烧的产物只通过碱石灰,碱石灰的质量会增加30.6g.若将燃烧产物只通过浓硫酸,浓硫酸的质量会增加10.8g.则该有机物A的分子式为C3H8O3.分析 在同温同压下,A蒸气对乙醇蒸气的相对密度是2,则A的相对分子质量=46×2=92,碱石灰的质量会增加30.6g为燃烧生成二氧化碳、水的质量之和,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g为水的质量,可以计算燃烧生成二氧化碳质量,计算有机物A、水、二氧化碳的物质的量,根据原子守恒计算有机物A分子中C、H原子数目,再根据相对分子质量计算O原子数目,进而确定有机物A的分子式.
解答 解:在同温同压下,A蒸气对乙醇蒸气的相对密度是2,则A的相对分子质量=46×2=92;
13.8g A完全燃烧后,将燃烧的产物通过碱石灰,碱石灰的质量会增加30.6g为燃烧生成二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加10.8g为水的质量,故燃烧生成二氧化碳质量=30.6g-10.8g=19.8g,
13.8g A的物质的量=$\frac{13.8g}{92g/mol}$=0.15mol,燃烧生成水的物质的量=$\frac{10.8g}{18g/mol}$=0.6mol,二氧化碳的物质的量=$\frac{19.8g}{44g/mol}$=0.45mol,
根据原子守恒,有机物A分子中C原子数目=$\frac{0.45mol}{0.15mol}$=3、H原子数目=$\frac{0.6mol×2}{0.15mol}$=8,故O原子数目=$\frac{92-12×3-8}{16}$=3,故有机物A的分子式为C3H8O3,
故答案为:C3H8O3.
点评 本题考查有机物分子式确定,难度不大,侧重对基础知识的巩固,掌握燃烧法利用原子守恒确定有机物分子式.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 乙烯和甲苯都能使酸性KMnO4溶液褪色 | |
| B. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 | |
| C. | CH2=CH2和CH3CH2Cl都属于烃 | |
| D. | C2H4和C4H8一定都能使溴水褪色 |
13.下列关于物质的用途说法不正确的是( )
| A. | SiO2通常用于通讯行业 | B. | 硅胶常用于食品袋中的干燥剂 | ||
| C. | SO2可用于食品行业的漂白剂 | D. | 氧化铝可用于制造坩埚 |
20.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有0.2mol电子转移,则消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应是:O2+4e-+2H2O═4OH- |
10.三氟化氮(NF3,无色气体,其中F为-1价)是微电子工业中一种优良的等离子蚀刻气体.在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关判断正确的是( )
| A. | 反应中NF3是氧化剂,H2O是还原剂 | |
| B. | NF3在潮湿空气中泄漏会产生无色气体 | |
| C. | 反应中还原剂与氧化剂的物质的量之比为1:2 | |
| D. | 若反应中生成0.1 mol HNO3,则反应共转移0.1 mol电子 |
17.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | KAl(SO4)2•12H2O可除去碱性废水中的悬浮颗粒 | |
| B. | 漂白粉的主要成分为氯化钙 | |
| C. | 实验室可用浓硫酸干燥氨气和氯气 | |
| D. | 实验室可用NaOH溶液处理NO和CO废气 |
14.下列有机反应的产物中不可能存在同分异构体的是( )
| A. | CH3CH═CH2与HCl加成 | |
| B. | CH3CH2CH2Cl在碱性溶液中水解 | |
| C. | CH2═CH-CH═CH2与H2按物质的量之比为1﹕1进行反应 | |
| D. | 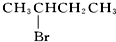 与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
15.分子式为C3H4ClBr链状有机物的同分异构体共有(不考虑顺反异构)( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |