题目内容
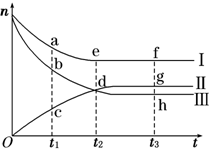 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.请回答下列问题:
(1)如图中属于氢气物质的量随时间变化的曲线是
(2)关于t2时刻的说法正确的是
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3:1:2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是
质,其正反应速率最小的点是
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那
么该温度可能是
A.673K B.273K C.373K
(5)在密闭容器中充入2mol N2和6mol H2,一定条件下建立平衡:N2(g)+3H2(g)?2NH3(g)
△H=-92.2kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:(1)以及化学方程式中的化学计量数和图象中物质的量的变化分析;
(2)t2时刻氢气和氨气的物质的量相等,反应未达到平衡状态,速率正比的与化学计量数之比相等,据此判断;
(3)合成氨开始后,正反应速率逐渐减小,逆反应速率逐渐增大,到平衡后,正逆反应速率相等,正反应速率最小,逆反应速率增大;
(4)合成氨是反应放热,温度改变后,n(H2)比图象中的值大,说明平衡逆向移动,温度升高平衡逆向移动;
(5)1mol氮气反应放热92.2KJ,据参加反应的氮气的物质的量判断放热多少;生成2mol氨气放热92.2KJ,分解2mol氨气吸热92.2KJ,据等效平衡原理判断分解氨气的物质的量计算吸热多少.
(2)t2时刻氢气和氨气的物质的量相等,反应未达到平衡状态,速率正比的与化学计量数之比相等,据此判断;
(3)合成氨开始后,正反应速率逐渐减小,逆反应速率逐渐增大,到平衡后,正逆反应速率相等,正反应速率最小,逆反应速率增大;
(4)合成氨是反应放热,温度改变后,n(H2)比图象中的值大,说明平衡逆向移动,温度升高平衡逆向移动;
(5)1mol氮气反应放热92.2KJ,据参加反应的氮气的物质的量判断放热多少;生成2mol氨气放热92.2KJ,分解2mol氨气吸热92.2KJ,据等效平衡原理判断分解氨气的物质的量计算吸热多少.
解答:
解:(1)氢气是反应物,其物质的量减少,且其减少量与氮气之比为3:1,可以判断Ⅲ为氢气,故答案为:Ⅲ;
(2)t2时刻氢气和氨气的物质的量相等,反应未达到平衡状态,
A、反应未达到平衡状态,故A错误;
B、t2时刻氢气和氨气的物质的量相等,反应速率不同,故B错误;
C、各物质反应速率之比始终大于化学计量数之比,故C正确;
D、t2时刻氢气和氨气的物质的量相等,故D正确;
故答案为:CD;
(3)合成氨开始后,正反应速率逐渐减小,逆反应速率逐渐增大,到平衡后,正逆反应速率相等,正反应速率最小,逆反应速率增大,故答案为:g;f;
(4)合成氨是反应放热,温度改变后,n(H2)比图象中的值大,说明平衡逆向移动,温度升高平衡逆向移动,温度高于500K,故答案为:A;
(5)参加反应的氮气的物质的量为90%×2mol=1.8mol,放热1.8mol×92.2KJ/mol=165.96KJ;在相同容器中充入2mol N2和6mol H2与充入4mol NH3达到平衡状态后,各物质浓度相同,充入2mol N2和6mol H2时,平衡后氮气有0.2mol,氢气有0.6mol、氨气有3.6mol,则加入4mol氨气,只反应0.4mol,生成2mol氨气放热92.2KJ,分解2mol氨气吸热92.2KJ,负极0.4mol氨气吸热0.4mol×
=18.44KJ,故答案为:165.96;吸收;18.44.
(2)t2时刻氢气和氨气的物质的量相等,反应未达到平衡状态,
A、反应未达到平衡状态,故A错误;
B、t2时刻氢气和氨气的物质的量相等,反应速率不同,故B错误;
C、各物质反应速率之比始终大于化学计量数之比,故C正确;
D、t2时刻氢气和氨气的物质的量相等,故D正确;
故答案为:CD;
(3)合成氨开始后,正反应速率逐渐减小,逆反应速率逐渐增大,到平衡后,正逆反应速率相等,正反应速率最小,逆反应速率增大,故答案为:g;f;
(4)合成氨是反应放热,温度改变后,n(H2)比图象中的值大,说明平衡逆向移动,温度升高平衡逆向移动,温度高于500K,故答案为:A;
(5)参加反应的氮气的物质的量为90%×2mol=1.8mol,放热1.8mol×92.2KJ/mol=165.96KJ;在相同容器中充入2mol N2和6mol H2与充入4mol NH3达到平衡状态后,各物质浓度相同,充入2mol N2和6mol H2时,平衡后氮气有0.2mol,氢气有0.6mol、氨气有3.6mol,则加入4mol氨气,只反应0.4mol,生成2mol氨气放热92.2KJ,分解2mol氨气吸热92.2KJ,负极0.4mol氨气吸热0.4mol×
| 92.2KJ |
| 2 |
点评:本题考查了据图象判断反应物和生成物、平衡状态判断、反应速率与平衡的关系、反应热的计算,题目难度较大.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
常温下,关于下列各溶液的叙述正确的是( )
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
下列关于电解质的说法正确的是( )
| A、SO2溶于水可以导电,说明SO2是电解质 |
| B、电解质本身可以导电,也可以不导电 |
| C、强电解质与弱电解质的差别就是溶液导电性不同 |
| D、物质的量浓度相同的NaOH溶液与氨水,氨水的pH值较小,说明氨水是弱电解质 |
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )


| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
下列各组中的两种物质作用时,反应条件或反应物用量改变时,对生成物没有影响的是( )
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |