题目内容
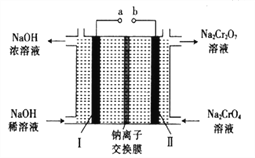
【题目】电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如下图所示。下列说法中,不正确的是
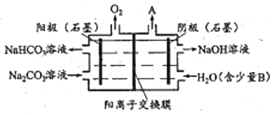
A. 阴极产生的物质A是H2
B. 溶液中Na+由阳极室向阴极室迁移
C. 物质B是NaCl,其作用是增强溶液导电性
D. 阳极OH-放电,H+浓度增大,CO32-转化为HCO3-
【答案】C
【解析】A. 水电离产生的氢离子在阴极得电子产生氢气,则物质A是H2,选项A正确;B.电解池中阳离子向阴极移动,则溶液中Na+由阳极室向阴极室迁移,选项B正确;C. 若物质B是NaCl,所制得氢氧化钠溶液中含有杂质,为增强溶液导电性可以是含有少量氢氧化钠的水溶液,选项C不正确;D. 阳极OH-放电产生氧气,H+浓度增大,CO32-转化为HCO3-,从而得到碳酸氢钠,选项D正确。答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
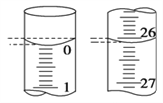
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数