题目内容
如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
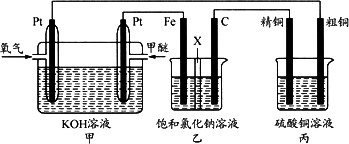
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式________.
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________.
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”).
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为________;丙装置中阴极析出铜的质量为________.
解析:
|
(1)正极(2分) CH3OCH3-12e-+16OH- (2)阴极(2分);2Cl--2e- (3)铁极(2分) (4)减小(2分) (5)0.2×6.02×1023(2分);12.8 g(2分) |

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
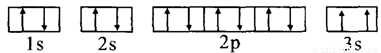
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4)G位于 族 区,价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为 cm
【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4)G位于 族 区,价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为 cm


 2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如下图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如下图所示。试回答下列问题: 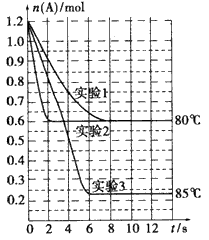

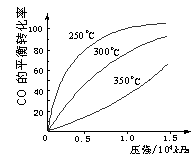 (2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生