题目内容
15.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
分析 活泼金属与活泼非金属元素一般形成离子键;金属单质是由金属键形成的金属晶体;根据元素在周期表中的位置判断价电子数;同周期从左到右阳离子半径依次减小.
解答 解:活泼金属与活泼非金属元素一般形成离子键,则NaCl、KCl、CaCl2均是由离子键构成的离子晶体;金属单质是由金属键形成的金属晶体,主族元素的价电子数等于其族序数,则Na的价电子数为1,Mg的价电子数为2,Al的价电子数为3,故价电子数由少到多的顺序是Na<Mg<Al;同周期从左到右阳离子半径依次减小,则粒子半径由大到小的顺序是Na+>Mg2+>Al3+.
故答案为:离子;离子;金属键结合而成;金属;Na<Mg<Al;Na+>Mg2+>Al3+.
点评 本题考查了化学键、晶体、离子半径大小比较,题目难度不大,注意把握微粒半径大小比较方法.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
20.解释下列事实的离子方程式不正确的是( )
| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
7.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.回答下列问题:
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
分析上表中的相关数据,请回答:NH3的沸点比PH3的高的原因是NH3存在分子间氢键;CH4的分解温度比SiH4的高的原因是C-H键的键能大于Si-H键的键能.
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图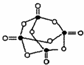 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH, (PAN)等二次污染物.
(PAN)等二次污染物.
①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图
 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH,
 (PAN)等二次污染物.
(PAN)等二次污染物.①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
4.下列说法正确的是( )
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
5.回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.