题目内容
3.一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成.某校化学研究性学习小组从定性方面对此作了研究.按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加.

试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接3(或4)、4(或3)接b,c接2、1接d;D、E两支试管中CCl4的作用是防止倒吸.
(2)能证明浓硫酸具有强氧化性的实验现象为C中品红溶液褪色;实验过程中,浓硫酸表现强氧化性的反应方程式是:Zn+2H2SO4=ZnSO4+SO2↑+2H2O.
(3)反应较长时间后气泡量又会明显增加的原因是浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2.
分析 (1)B的作用是防止倒吸;C装置的作用是检验二氧化硫的漂白性,可用洗气装置; 乙可防止倒吸;
(2)浓硫酸与锌反应生成硫酸锌、二氧化硫气体和水,有二氧化硫生成能证明浓硫酸具有强氧化性;
(3)随反应进行浓H2SO4变成稀H2SO4,锌与稀硫酸反应生成氢气.
解答 解:(1)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,DE中的四氯化碳可以防止气体吸收时倒吸;
故答案为:3(或4);4(或3); 2; 1;防止倒吸;
(2)浓硫酸与锌反应的化学方程式为:Zn+2H2SO4=ZnSO4+SO2↑+2H2O,有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,
故答案为:C中品红溶液褪色;Zn+2H2SO4=ZnSO4+SO2↑+2H2O;
(3)随反应的进行浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2,所以生成气泡量又会明显增加,
故答案为:浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2.
点评 本题考查了浓硫酸的性质、二氧化硫的检验方法,题目难度中等,注意掌握铜与浓硫酸的反应原理,本题中注意锌能够浓硫酸、稀硫酸反应,明确实验目的及基本操作方法为解答关键.

练习册系列答案
相关题目
8.某化学兴趣小组设计如图所示装置来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物.下列说法不正确的是( )
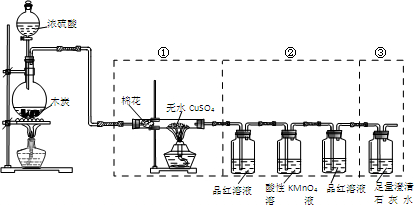

| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
15.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:
晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小.A组是离子晶体,晶体微粒之间通过离子相连.B组晶体属金属键结合而成的金属晶体,价电子数由少到多的顺序是Na<Mg<Al,粒子半径由大到小的顺序是Na+>Mg2+>Al3+.
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液K+、Na+、AlO2-、CO32- |
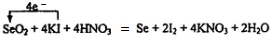 .
.