题目内容
将a g MgCO3与b g NaHCO3分别加入到100mL1mol/L的盐酸溶液中,都完全溶解,若反应后所得两种溶液的质量相等,则a和b的关系及取值范围是 .
考点:有关混合物反应的计算
专题:计算题
分析:MgCO3与NaHCO3分别加入到盐酸溶液中,发生反应:MgCO3+2HCl=MgCl2+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,100mL1mol/L的盐酸溶液中HCl的物质的量=0.1L×1mol/L=0.1mol,若HCl均完全反应,根据方程式可知:
MgCO3+2HCl=MgCl2+CO2↑+H2O 溶液质量增重
2mol 84g-44g=40g
0.1mol 2g
NaHCO3+HCl=NaCl+CO2↑+H2O 溶液质量增重
1mol 84g-44g=40g
0.1mol 4g
由于反应后所得两种溶液的质量相等,则溶液质量增重相等,故碳酸氢钠与盐酸反应时,盐酸有剩余,碳酸镁完全反应,据此结合方程式计算.
MgCO3+2HCl=MgCl2+CO2↑+H2O 溶液质量增重
2mol 84g-44g=40g
0.1mol 2g
NaHCO3+HCl=NaCl+CO2↑+H2O 溶液质量增重
1mol 84g-44g=40g
0.1mol 4g
由于反应后所得两种溶液的质量相等,则溶液质量增重相等,故碳酸氢钠与盐酸反应时,盐酸有剩余,碳酸镁完全反应,据此结合方程式计算.
解答:
解:MgCO3与NaHCO3分别加入到盐酸溶液中,发生反应:MgCO3+2HCl=MgCl2+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,100mL1mol/L的盐酸溶液中HCl的物质的量=0.1L×1mol/L=0.1mol,若HCl均完全反应,根据方程式可知:
MgCO3+2HCl=MgCl2+CO2↑+H2O 溶液质量增重
84g 2mol 84g-44g=40g
4.2g 0.1mol 2g
NaHCO3+HCl=NaCl+CO2↑+H2O 溶液质量增重
84g 1mol 84g-44g=40g
8.4 0.1mol 4g
由于反应后所得两种溶液的质量相等,则溶液质量增重相等,故碳酸氢钠与盐酸反应时,盐酸有剩余,碳酸镁完全反应,故g≤4.2,b<8.4,则ag-
×44g/mol=bg-
×44g/mol,故a=b,且a≤4.2,
故答案为:a=b,且a≤4.2.
MgCO3+2HCl=MgCl2+CO2↑+H2O 溶液质量增重
84g 2mol 84g-44g=40g
4.2g 0.1mol 2g
NaHCO3+HCl=NaCl+CO2↑+H2O 溶液质量增重
84g 1mol 84g-44g=40g
8.4 0.1mol 4g
由于反应后所得两种溶液的质量相等,则溶液质量增重相等,故碳酸氢钠与盐酸反应时,盐酸有剩余,碳酸镁完全反应,故g≤4.2,b<8.4,则ag-
| ag |
| 84g/mol |
| bg |
| 84g/mol |
故答案为:a=b,且a≤4.2.
点评:本题考查混合物计算,关键是利用假设法确定的反应过量情况,侧重对学生分析思维能力的考查,难度中等.

练习册系列答案
相关题目
某高分子化合物的结构简式为 ,该物质可由下列哪组物质为原料直接合成得到( )
,该物质可由下列哪组物质为原料直接合成得到( )
 ,该物质可由下列哪组物质为原料直接合成得到( )
,该物质可由下列哪组物质为原料直接合成得到( )A、 和CH3CH2OH 和CH3CH2OH |
B、 和HOCH2CH2OH 和HOCH2CH2OH |
C、 和CH3CH2OH 和CH3CH2OH |
D、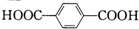 和HOCH2CH2OH 和HOCH2CH2OH |
下列溶液中滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是( )
| A、氯化钡 | B、氢氧化钡 |
| C、碳酸钠 | D、氢氧化钾 |
实验操作的规范是实验的基本要求.下列实验操作正确的是( )
A、 闻气体气味 |
B、 点燃酒精灯 |
C、 过滤 |
D、 移开蒸发皿 |
