题目内容
7.下列微粒中,未成对电子数最多的是( )| A. | 氮原子 | B. | 氧原子 | C. | 铁离子 | D. | 铬原子 |
分析 根据能量最低原理书写各微粒的电子排布式,根据电子排布式判断未成对电子数,可解答该题.
解答 解:A.N的电子排布式为1s22s22p3,未成对电子数为3;
B.O的电子排布式为1s22s22p4,未成对电子数为2;
C.铁离子的电子排布式为1s22s22p63s23p63d5,未成对电子数为5;
D.Cr的电子排布式为1s22s22p63s23p63d54s1,未成对电子数是6;
比较可知Cr的未成对电子数为6,最多,
故选D.
点评 本题考查原子核外电子的排布,题目难度中等,注意根据电子排布式判断未成对电子数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列各组离子在特定条件下能够大量共存的是( )
| A. | 无色溶液:SO42-、Cl-、Mg2+、NH4+ | |
| B. | 含有较多Ag+溶液:SO42-、K+、Na+、OH- | |
| C. | 能使石蕊试纸变红色的溶液:K+、SO32-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液:Na+、SO42-、AlO2-、K+ |
15.国内科研机构对城市雾霾天气进行了研究,一种新的污染物过氧乙酰硝酸酯(PAN)被检出引起了人们的注意,研究表明对眼睛具有强烈刺激作用的过氧乙酰硝酸酯产生原理可用以下方程式表示为C2H6+NO2+O2→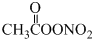 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )
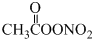 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
2.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |
19.下列有关化学用于正确的是( )
| A. | NaHSO4的电离:NaHSO4=Na++H++SO${\;}_{4}^{2-}$ | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | S2-的结构示意图: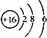 | |
| D. | 质子数为94,中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
16.下列离子方程式正确的是( )
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |