题目内容
12.向Ba(OH)2溶液中逐滴加入明矾[KAl(SO4)2]至溶液中Ba2+恰好完全沉淀,此反应的离子方程式是Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+2H2O,在以上溶液中继续滴加明矾溶液,请写出此步反应的离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓.分析 钡离子恰好完全反应时,氢氧化钡与硫酸铝钾的物质的量之比为2:1,铝离子恰好完全反应生成偏铝酸根离子;继续滴加明矾溶液,铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,以此来解答.
解答 解:向Ba(OH)2溶液中,逐滴加入明矾溶液至Ba2+恰好完全沉淀,铝离子完全反应生成偏铝酸根离子,反应的离子方程式为Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+2H2O;若继续滴加明矾,铝离子会与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | 以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O=H2↑+Cl2↑+2OH- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |
3.已知常温下,浓度均为0.1mol•L-1的5种钠盐溶液pH如表:
下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
20. 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因酸性较强时,Cl2+H2O?H++Cl-+HClO的化学平衡逆向移动,生成的HClO减少,不利脱氮.
 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中•OH |
7.下列微粒中,未成对电子数最多的是( )
| A. | 氮原子 | B. | 氧原子 | C. | 铁离子 | D. | 铬原子 |
17.用下列装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 |  | 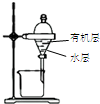 有机层水层 | 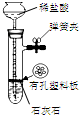 | 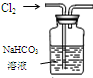 |
| 目的 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 制取少量CO2气体 | 除去Cl2中含有的少量HCl |
| A. | A | B. | B | C. | C | D. | D |
4.在过氧化钾与水的反应中,其还原产物和氧化产物质量比为( )
| A. | 7:2 | B. | 4:7 | C. | 7:4 | D. | 9:8 |
3.实验室可用如图所示装置制取的气体是( )
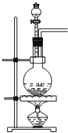

| A. | Cl2 | B. | C2H4 | C. | C2H2 | D. | CO2 |