题目内容
6.下列说法正确的是( )| A. | 沸点大小:HI>HBr>HCl>HF | |
| B. | HF很稳定性很强,是因为分子间能形成氢键 | |
| C. | 冰、水和水蒸气中都含有氢键 | |
| D. | 构成单质分子的微粒之间不一定存在共价键 |
分析 A.HF分子间存在氢键,沸点最高,HI、HBr、HCl结构相似,相对分子质量越大,分子间作用力越强,沸点越高;
B.氢化物稳定性与非金属性越强有关,与氢键无关;
C.水蒸气分子间不存在氢键;
D.稀有气体为单原子分子,分子中不存任何化学键.
解答 解:A.HF分子间存在氢键,沸点最高,HI、HBr、HCl结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以沸点HF>HI>HBr>HCl,故A错误;
B.F的非金属性最强,则HF的稳定性最强,与HF分子间存在氢键无关,故B错误;
C.冰、水分子中存在氢键,而水蒸气中由于分子间距离过大,不存在氢键,故C错误;
D.构成单质分子的粒子之间不一定存在共价键,如稀气体之间不存任何化学键,故D正确;
故选D.
点评 本题考查较为综合,涉及氢键、元素周期律、化学键等知识,题目难度不大,明确元素周期律的内容为解答关键,D为易错点,注意稀有气体分子组成特点,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作 | 现象 | |
① | 加入NaOH溶液 | 有红褐色沉淀 |
② | 加入Ba(NO3)2溶液 | 有白色沉淀 |
③ | 加入酸性KMnO4溶液 | 紫色褪去 |
④ | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
A.②④ B.④ C.②③④ D.①②③④
19. X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | B. | Y、W的最简单氢化物能相互反应 | ||
| C. | 非金属性:Z<W | D. | X、Z、W形成的化合物均为强酸 |
15.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. |  | B. |  | C. | CH2=CH-CH=CH2 | D. | CH2=CH-CN |
2.维生素C的结构简式如图所示.则有关它的叙述中错误的是( )
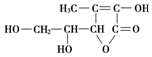

| A. | 易发生氧化及加成反应 | B. | 在碱性溶液中能稳定地存在 | ||
| C. | 能与乙酸发生酯化反应 | D. | 是一个环状的酯类化合物 |
17.下列物质中属于非电解质的是( )
| A. | N2 | B. | 醋酸 | C. | 氨气 | D. | BaSO4 |
14.下列物质中,既有离子键,又有共价键的是( )
| A. | HCl | B. | NH4NO3 | C. | KCl | D. | CaCl2 |
 如图所示,组成一种原电池.试回答下列问题:
如图所示,组成一种原电池.试回答下列问题: 的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣