题目内容
15.下列变化过程需要吸收能量的是( )| A. | 白磷在空气中自燃 | B. | CaO+H2O=Ca(OH)2 | ||
| C. | 酸碱中和反应 | D. | H2→H+H |
分析 A、所有燃烧为放热反应;
B、活泼金属氧化物与水的反应为放热反应;
C、中和反应是放热反应;
D、断裂化学键吸收能量.
解答 解:A、所有燃烧为放热反应,故A错误;
B、活泼金属氧化物与水的反应为放热反应,故B错误;
C、中和反应是放热反应,故C错误;
D、断裂化学键吸收能量,故D正确.
故选D.
点评 本题考查了化学反应的本质,化学键断裂吸热,化学键形成放热,金属钠与水反应,中和反应等分析应用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.在一定温度下,将2mol SO2和1mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1,当达到化学平衡时,下列说法中正确的是( )
| A. | 生成SO3 2 mol | B. | SO2和SO3共2 mol | C. | 放出197 kJ热量 | D. | 含氧原子共8 mol |
6.美国FDA证实,该国地质勘测局在内华达州法隆镇的一些奶牛场附近的井水中发现了84号元素Po(钋)的一种放射性致癌同位素.钋是目前已知最稀有的元素之一,下列有关它的说法正确的是( )
| A. | 门捷列夫能预测钋在地球上的分布 | B. | 钋在第七周期第ⅥA族 | ||
| C. | 钋的最外层电子数为6 | D. | 钋属于副族元素 |
3.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 H2S | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
10.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大.其相关信息如下表:
(1)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为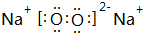 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为
 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
20.下列说法正确的是( )
| A. | 钢铁发生电化学腐蚀时,负极反应都是Fe-3e-=Fe3+ | |
| B. | 镀锡的铁制品,若发生镀层破损,铁制品比受损前更容易锈蚀 | |
| C. | 铜的金属活动性比铁弱,可在海轮外壳上装上铜块以减缓船体腐蚀 | |
| D. | 钢铁发生吸氧腐蚀时,正极反应是:2H2O+O2+4e-=4OH- |
7. 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
分析上述数据,回答下列问题:
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
4.下列说法不正确的是( )
| A. | 核素${\;}_{116}^{297}$Lv的中子数是181 | B. | 红磷和白磷互为同素异形体 | ||
| C. | CH4O和C2H6O互为同系物 | D. | 丁烷(C4H10)具有2种同分异构体 |
5.下列物质既属于无机物,又属于碱的是( )
| A. | Na2CO3 | B. | CH3OH | C. | Al2O3 | D. | Cu(OH)2 |