题目内容
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴指 ( )


| A.平衡混合气中反应物A的百分含量 |
| B.平衡混合气中反应物B的百分含量 |
| C.平衡混合气的密度 |
| D.平衡混合气的平均摩尔质量 |
由C的百分含量--时间变化曲线可知:在相同温度线,增大压强(P2>P1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x,
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,则
A.由C的百分含量--时间变化曲线可知,增大压强平衡向正反应方向移动,A的百分含量减小,与图象不符,故A错误;
B.由C的百分含量--时间变化曲线可知,增大压强平衡向正反应方向移动,B的百分含量减小,与图象不符,故B错误
C.由于反应容器的体积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,故C错误;
D.升高温度,平衡向逆反应分析移动,则混合气体的物质的量增多,质量不变,则平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,气体的总物质的量减小,则平衡混合气的平均摩尔质量增大,与图象向符合,故D正确.
故选D.
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,则
A.由C的百分含量--时间变化曲线可知,增大压强平衡向正反应方向移动,A的百分含量减小,与图象不符,故A错误;
B.由C的百分含量--时间变化曲线可知,增大压强平衡向正反应方向移动,B的百分含量减小,与图象不符,故B错误
C.由于反应容器的体积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,故C错误;
D.升高温度,平衡向逆反应分析移动,则混合气体的物质的量增多,质量不变,则平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,气体的总物质的量减小,则平衡混合气的平均摩尔质量增大,与图象向符合,故D正确.
故选D.

练习册系列答案
相关题目
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+bB(g)?xC(g),符合图1所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图2中,Y轴是指( )
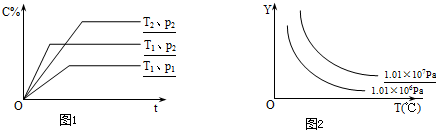
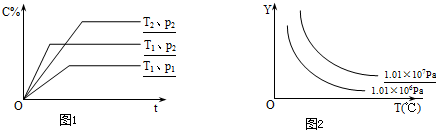
| A、反应物A的百分含量 | B、反应物B的平衡转化率 | C、平衡混合气的密度 | D、平衡混合气的总物质的量 |
