题目内容
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |
B
解析试题分析:A、可以含有非极性键,如双氧水,错误;B、共价化合物熔融不电离,正确;C、铵盐为离子化合物,错误;D、分子晶体的溶沸点与分子间作用力有关于化学键无关,错误。
考点:考查晶体性质和构成有关问题。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。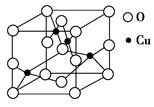
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下: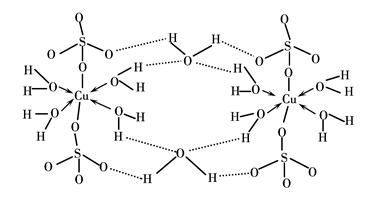
下列说法正确的是________(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________________________________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_________________________________________________________________。
下列各组物质,化学键类型相同、晶体类型也相同的是
A.SO2和 | B.CCl4和KCl | C.NaCl和HCl | D.CO2和H2S |
下列说法中错误的是
| A.当中心原子的配位数为6时,配合单元常呈八面体空间结构 |
| B.SO3为平面正三角形结构 |
| C.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
| D.配位数为4的配合物均为正四面体结构 |
下列化学式能真实表示物质分子组成的是
| A.NaOH | B.SO2 | C.P(白磷) | D.SiO2 |
下列有关晶体的叙述中,错误的是
| A.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏 |
| B.白磷晶体中,结构粒子之间通过共价键结合 |
| C.石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体 |
| D.构成分子晶体的结构粒子中不一定存在共价键 |
关于晶体的叙述中,正确的是
| A.原子晶体中,共价键的键能越大,熔、沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔、沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新材料给予了极大的关注。纳米粒子是指直径为1~100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性能,可开发为新型功能材料,有关纳米粒子的叙述不正确的是( )。
| A.因纳米粒子半径太小,故不能将其制成胶体 |
| B.一定条件下纳米粒子可催化水的分解 |
| C.一定条件下,纳米陶瓷可发生任意弯曲,可塑性好 |
| D.纳米粒子半径小,表面活性高 |