题目内容
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。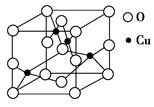
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下: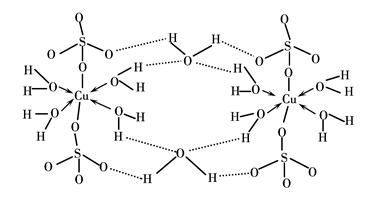
下列说法正确的是________(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________________________________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_________________________________________________________________。
(1)1s22s22p63s23p63d9或[Ar]3d9
(2)4
(3)BD
(4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。
(5)高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高。
解析

下列说法正确的是 ( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
| A.①③⑤ | B.②④⑤ | C.②③④ | D.①③ |
已知N、P同属元素周期表的第ⅤA族元素,N在第二周期,P在第三周期,NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N—H键间的夹角是107.3°。
(1)PH3分子与NH3分子的构型关系是____________(填“相同”、“相似”或“不相似”)______________(填“有”或“无”)P—H键,PH3分子是______________(填“极性”或“非极性”)分子。
(2)NH3与PH3相比,热稳定性更强的是____________,原因是_____________。
(3)NH3和PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________________。
| A.键的极性N—H比P—H强 |
| B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 |
| D.NH3分子之间存在特殊的分子间作用力 |
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |