题目内容
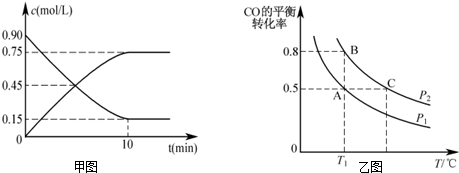
11. 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g) 求:
(1)加入NaOH溶液0--20mL过程中反应的离子方程式为H++OH-=H2O;沉淀中Al(OH)3的质量为7.8g.
(2)合金中Mg的质量为4.8g;所用HCl的物质的量浓度为8mol/L.
分析 (1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,溶解氢氧化铝消耗NaOH溶液20mL,根据方程式计算n[Al(OH)3];
(2)从加入20m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol,进而计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;
沉淀量最大时,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,反应离子方程式为:H++OH-=H2O,
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,则m[Al(OH)3]=0.1mol×78g/mol=7.8g,
故答案为:H++OH-=H2O;7.8g;
(2)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g.
沉淀量最大时,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为$\frac{0.8mol}{0.1L}$=8mol/L.
故答案为:4.8;8.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | 除去乙醇中的水:加入生石灰,蒸馏 | |
| C. | 为除去乙炔气中少量的H2S,可使其通过CuSO4溶液 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
| A. | 氯仿 | B. | 1-氯丙烷 | C. | 2-丁醇 | D. | 2-甲基-2-溴丙烷 |
| A. | 碳酸钙和盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁:3Fe+6H+═3Fe3++3H2↑ | |
| D. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ |
| A. | 鉴别碳酸钠和碳酸氢钠溶液,用澄清石灰水 | |
| B. | 除去碳酸氢钠溶液中的碳酸钠,用稀盐酸 | |
| C. | 除去MgCl2溶液中的FeCl3,加NaOH调pH | |
| D. | 检验FeCl2溶液中混有的FeCl3,可用NH4SCN溶液 |
 (1)根据要求填空:
(1)根据要求填空: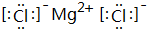
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: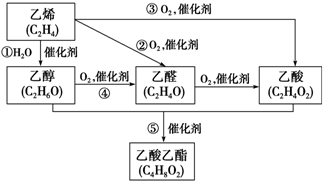 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线: