题目内容
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)??B(g)+C(g) ΔH=+85.1 kJ·mol-1
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
(1)升高温度、降低压强
(2)(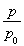 —1)×100% 94.1%
—1)×100% 94.1%
A(g)  B(g) + C(g)
B(g) + C(g)
0.10 0 0
0.10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=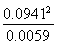 =1.5
=1.5
(3)①0.10×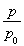 0.10×(2—
0.10×(2—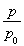 ) ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
) ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
【解析】 (1)要提高A的转化率,实际就是使平衡正向移动,根据方程式的特点正反应为气体物质的量增大的反应,且为吸热反应,可确定采取的措施。
(2)由阿伏加德罗定律推论可知,在恒温、恒容条件下,压强与物质的量成正比,将压强变化转化为物质的量变化,从而解决压强与转化率的关系。
A(g) B(g)+ C(g)
B(g)+ C(g)
假设起始物质
的量为1 mol 1 0 0
转化物质的量 a a a
反应到某时刻 1-a a a
所以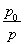 =
= ,解得a=(
,解得a=(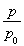 -1) mol。
-1) mol。
α(A)=(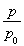 -1)×100%
-1)×100%
平衡时A的转化率=( -1)×100%≈94.1%。
-1)×100%≈94.1%。
(3)①与(2)思路相似,应用阿伏加德罗定律推论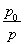 =
=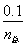 ,得n总=0.10×
,得n总=0.10×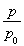 。
。
由方程式特点,应用差量法可知,反应过程增加的气体的物质的量,恰好等于反应的A的物质的量。
即:0.1-n(A)=n(总)-0.1
解得n(A)=0.2-0.1×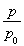
②从上表读出4 h时p=7.31
计算得n(A)=0.2-0.1×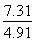 ≈0.051
≈0.051
依据此表中相邻两数据的差,即可得出规律。

 阅读快车系列答案
阅读快车系列答案V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2













