题目内容
20.一根蘸有浓氨水的玻璃棒靠近另一根蘸有某种酸的玻璃棒,产生大量白烟,所用的酸可能是( )| A. | 浓硝酸 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 浓磷酸 |
分析 蘸有浓氨水的玻棒靠近下列各浓酸时,产生白烟,说明酸易挥发,能在空气中形成小颗粒,以此解答该题.
解答 解:蘸有浓氨水的玻棒靠近下列各浓酸时,产生白烟,说明酸易挥发,能在空气中形成小颗粒,则HCl、HNO3两种酸都易挥发,与浓氨水反应均有白烟产生,而浓H2SO3、磷酸为难挥发性的酸,不能形成白烟,
故选AC.
点评 本题考查氨气的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,题目难度不大,注意能形成的白烟的酸必定是易挥发的酸的这一特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.常温下,若将pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A. | 生成了一种强酸弱碱盐 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液 |
11.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 非金属性:Y>Z | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
8.下列描述中正确的是( )
| A. | CS2为直线形的极性分子 | |
| B. | CH4中键能、键长和键角均相同 | |
| C. | AB2为V形,则A一定为sp2杂化 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
5.X元素最高价氧化物对应水化物化学式为H4XO4,则对应的氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
12.下列方程式表示的反应既不属于加成反应也不属于取代反应的是( )
| A. | C6H5CH2Cl+NaCN→C6H5CH2CN+NaCl | |
| B. | C6H5Li+CO2→C6H5COOLi | |
| C. | CH3CH2CHO+HCN$\stackrel{NaOH}{→}$ | |
| D. | CH3COOCH2CH3$→_{气相}^{450℃}$CH3COOH+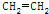 |
 -CH3
-CH3