题目内容
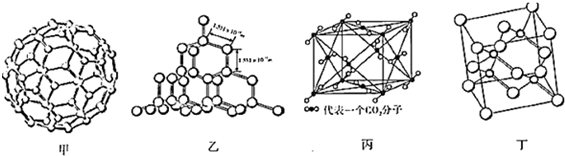
下图是C60、硅、干冰和砷化镓的晶体结构或分子模型.
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式: .
(2)从晶体类型来看,C60(如图甲)属于 晶体.
(3)二氧化硅结构跟晶体硅(如图乙)的结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙晶体硅的结构,结合题中所给二氧化硅的结构信息,分析晶体二氧化硅中硅原子与共价键的个数比为 .
(4)图丙是干冰的晶胞模型,图中显示出的二氧化碳分子数为14个.实际上一个二氧化碳晶胞中含有 个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为 .
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一.丙烷和丙烯分子中2号碳原子的杂化方式分别是 和 .
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,图丁的砷化镓晶胞.试回答下列问题:
①下列说法正确的是 (填序号).
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As<Ga
C.电负性:As<Ga D.砷和镓都属于p区元素
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为 .

请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:
(2)从晶体类型来看,C60(如图甲)属于
(3)二氧化硅结构跟晶体硅(如图乙)的结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙晶体硅的结构,结合题中所给二氧化硅的结构信息,分析晶体二氧化硅中硅原子与共价键的个数比为
(4)图丙是干冰的晶胞模型,图中显示出的二氧化碳分子数为14个.实际上一个二氧化碳晶胞中含有
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一.丙烷和丙烯分子中2号碳原子的杂化方式分别是
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,图丁的砷化镓晶胞.试回答下列问题:
①下列说法正确的是
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As<Ga
C.电负性:As<Ga D.砷和镓都属于p区元素
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为
考点:晶胞的计算,原子核外电子排布
专题:化学键与晶体结构
分析:(1)硅的原子数序为14,根据能量最低原理书写电子排布式;
(2)C60有固定的组成,不属于空间网状结构,以此判断晶体类型;
(3)根据图乙晶体硅的结构可知,其最小的环为六元环判断二氧化硅的空间网状结构中,每个Si原子周围要吧形成四个共价键,每2个Si原子之间有1个O原子,由此可以判断硅原子与共价键的个数比目;
(4)利用均摊法计算晶胞;根据二氧化碳的结构式判断共价键的类型和数目;
(5)通过价层电子对判断原子的杂化类型;
(6)①A.对比GaAs与NaCl中阴阳离子在晶胞中的分布可判断晶胞结构是否一样;
B.同周期元素从左到右第一电离能逐渐增大;
C.同周期元素从左到右电负性逐渐增大;
D.根据砷和镓的价层电子特点判断;
②根据反应物、生成物结合反应条件可书写化学方程式.
(2)C60有固定的组成,不属于空间网状结构,以此判断晶体类型;
(3)根据图乙晶体硅的结构可知,其最小的环为六元环判断二氧化硅的空间网状结构中,每个Si原子周围要吧形成四个共价键,每2个Si原子之间有1个O原子,由此可以判断硅原子与共价键的个数比目;
(4)利用均摊法计算晶胞;根据二氧化碳的结构式判断共价键的类型和数目;
(5)通过价层电子对判断原子的杂化类型;
(6)①A.对比GaAs与NaCl中阴阳离子在晶胞中的分布可判断晶胞结构是否一样;
B.同周期元素从左到右第一电离能逐渐增大;
C.同周期元素从左到右电负性逐渐增大;
D.根据砷和镓的价层电子特点判断;
②根据反应物、生成物结合反应条件可书写化学方程式.
解答:
解:(1)硅的原子数序为14,根据能量最低原理可知电子排布式为1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)C60有固定的组成,不属于空间网状结构,熔沸点远低于金刚石等原子晶体的熔沸点,应为分子晶体,故答案为:分子;
(3)根据图乙晶体硅的结构可知,其最小的环为六元环判断二氧化硅的空间网状结构中,每个Si原子周围要形成四个共价键,每2个Si原子之间有1个O原子,由此可以判断硅原子与共价键的个数比目为1:4,故答案为:1:4;
(4)二氧化碳的晶胞中,二氧化碳分子分布于晶胞的定点和面心位置,则晶胞中含有二氧化碳的分子数为
×8+6×
=4,二氧化碳的分子结构为O=C=O,每个分子中含有2个σ键和2个π键,所以σ键与π键的个数比为1:1,故答案为:4;1:1;
(5)丙烷分子中2号碳原子形成4个σ键,无孤电子对,所以杂化方式是sp3,丙烯分子中2号碳原子碳原子形成3个σ键,无孤电子对,所以杂化方式是sp2,故答案为:sp3;sp2;
(6)①A.GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;
B.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故B错误;
C.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故C错误;
D.砷和镓的价层电子都为sp电子,位于周期表p区,故D正确;
故答案为:D;
(2)反应为(CH3)3Ga和AsH3,生成为GaAs,根据质量守恒可知还应有和CH4,反应的化学方程式为:(CH3)3Ga+AsH3
GaAs+3CH4,故答案为:(CH3)3Ga+AsH3
GaAs+3CH4.
(2)C60有固定的组成,不属于空间网状结构,熔沸点远低于金刚石等原子晶体的熔沸点,应为分子晶体,故答案为:分子;
(3)根据图乙晶体硅的结构可知,其最小的环为六元环判断二氧化硅的空间网状结构中,每个Si原子周围要形成四个共价键,每2个Si原子之间有1个O原子,由此可以判断硅原子与共价键的个数比目为1:4,故答案为:1:4;
(4)二氧化碳的晶胞中,二氧化碳分子分布于晶胞的定点和面心位置,则晶胞中含有二氧化碳的分子数为
| 1 |
| 8 |
| 1 |
| 2 |
(5)丙烷分子中2号碳原子形成4个σ键,无孤电子对,所以杂化方式是sp3,丙烯分子中2号碳原子碳原子形成3个σ键,无孤电子对,所以杂化方式是sp2,故答案为:sp3;sp2;
(6)①A.GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;
B.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故B错误;
C.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故C错误;
D.砷和镓的价层电子都为sp电子,位于周期表p区,故D正确;
故答案为:D;
(2)反应为(CH3)3Ga和AsH3,生成为GaAs,根据质量守恒可知还应有和CH4,反应的化学方程式为:(CH3)3Ga+AsH3
| ||
| ||
点评:本题考查较为综合,涉及电子排布式的书写、晶胞的结构、杂化类型的判断以及有机结构的分析、元素周期律及化学方程式的书写,题目较难,注意把握相关知识思路的整理和积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法不正确的是( )
| 180℃ |
| 催化剂 |
| A、每转化掉1mol NO和1mol NO2混合气体,反应转移6mol电子 |
| B、升高温度,可使该反应的反应速率增大 |
| C、平衡时,其他条件不变,升高温度则该反应的平衡常数减少 |
| D、其他条件不变,使用高效催化剂平衡会发生移动,氮氧化物的转化率增大 |
为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A、Na2CO3 |
| B、NaOH |
| C、NH3?H2O |
| D、CuO |
工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物--合金.这是制取合金的常用方法之一.根据下表数据判断,不宜用上述方法制取合金的是( )
| 金属 | Na | Al | Cu | Fe |
| 熔点(℃) | 97.81 | 660 | 1083 | 1535 |
| 沸点(℃) | 883 | 2200 | 2595 | 3000 |
| A、Fe-Cu合金 |
| B、Cu-Al合金 |
| C、Al-Na合金 |
| D、Cu-Na合金 |
分析下面的能量变化图,判断下列选项中正确的是( )


| A、2A(g)+B(g)═2C(g)△H>0 |
| B、2A(g)+B(g)═2C(g)△H<0 |
| C、2A+B═2C△H<0 |
| D、2C═2A+B△H<0 |
 将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.
将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.
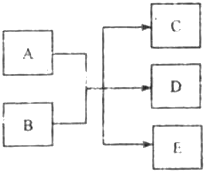 在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):