题目内容
14.下列叙述不正确的是( )| A. | 与28 gCO具有相同分子数的C2H4的质量一定是28 g | |
| B. | 1 molAl 3+含有的核外电子数为3NA | |
| C. | 常温常压下,1 mol甲烷含有的原子数为5NA | |
| D. | 常温常压下,1 molL氢气的体积大于22.4 L |
分析 A.乙烯与一氧化碳具有相同的摩尔质量,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$判断;
B.1个铝离子含有10各 电子;
C.1个甲烷分子含有5个原子;
D.常温常压下,Vm>22.4L/mol;
解答 解:A.乙烯与一氧化碳具有相同的摩尔质量,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$可知,二者分子数之比等于质量之比,故A正确;
B.molAl 3+含有的核外电子数为30NA,故B错误;
C.1个甲烷分子含有5个原子,1 mol甲烷含有的原子数为5NA,与温度压强无关,故C正确;
D.常温常压下,Vm>22.4L/mol,所以常温常压下,1 molL氢气的体积大于22.4 L,故D正确;
故选:B.
点评 本题考查了阿伏伽德罗常数及相关计算,熟悉以物质的 量为核心的计算公式,明确相关物质的结构组成是解题关键,题目难度不大.

练习册系列答案
相关题目
5.做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 | |
| D. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 |
9.2016年第31届奥运会在巴西里约举行.奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P=3P2O5+5KC1.下列有关该反应的叙述中,正确的是( )
| A. | 氯酸钾是还原剂 | |
| B. | KCl既是氧化产物,又是还原产物 | |
| C. | 反应中消耗3mol P时,转移电子的物质的量为15mol | |
| D. | 发令时产生的白烟只是KCl固体颗粒 |
19.NaOH是一种重要的化学试剂,其摩尔质量为( )
| A. | 20g | B. | 20g•mol-1 | C. | 40mol•g-1 | D. | 40g•mol-1 L |
6.下列物质属于纯净物的是( )
| A. | 冰水混合物 | B. | 玻璃 | C. | 空气 | D. | 漂白粉 |
3.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的美景仙境,其本质原因是( )
| A. | 夜里的月色本身就很美 | |
| B. | 空气中的小水滴颗粒直径约为1nm-100nm | |
| C. | 光线是一种胶体 | |
| D. | 雾是一种胶体,能产生丁达尔现象 |
7.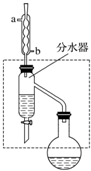 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH$?_{浓H_{2}SO_{4}}^{△}$ CH3COOCH2CH2CH2CH3+H2O
(1)乙酸丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是c(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{浓H_{2}SO_{4}}^{△}$ CH3COOCH2CH2CH2CH3+H2O
| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是c(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
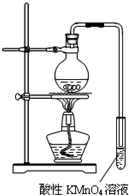 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.