题目内容
11.下列离子方程式书写正确的是( )| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.原子个数不守恒;
B.二者反应生成硝酸铜、一氧化氮和水;
C.不符合反应客观事实;
D.碳酸氢钠足量反应生成碳酸钙、碳酸钠和水.
解答 解:A.金属钠投入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.铜加入稀硝酸中,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B正确;
C.氯化铝溶液中通入过量氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.澄清石灰水与过量NaHCO3溶液混合,离子方程式:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故D错误;
故选B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
相关题目
1.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,28gN2与CO混合物气体中所含的分子数目一定为NA | |
| B. | 标准状况下,17g氨气所含原子数目为NA | |
| C. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| D. | NA个氢分子所占有的体积一定为22.4L |
2.将某无色气体X通入品红溶液,溶液褪色;加热,溶液又变红色,X可能是( )
| A. | O2 | B. | Cl2 | C. | SO2 | D. | CO2 |
19.能说明某温度下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中,已达到平衡状态的是( )
| A. | NH3、NO消耗的速率相等 | |
| B. | 容器内NH3、O2、NO、H2O四种气体共存 | |
| C. | NO、H2O的生成速率相等 | |
| D. | 单位时间内NH3、O2消耗的物质的量相等 |
6.如图是自来水表的常见安装方式.下列有关说法不正确的是( )


| A. | 发生腐蚀过程中,电子从接头流向水表 | |
| B. | 腐蚀时,铁接头发生的是还原反应 | |
| C. | 腐蚀时铜质水表发生的电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 |
16.乳酸的结构简式为CH3CH(OH)COOH,下列说法不正确的是( )
| A. | lmol乳酸可与2mo1Na反应,生成lmol气体 | |
| B. | 乳酸可以发生加聚反应 | |
| C. | 乳酸可以发生取代反应、氧化反应、酯化反应 | |
| D. | 乳酸可以生成分子式为C6H8O4的酯 |
3.下列物质属于电解质的是( )
| A. | 豆浆 | B. | NaCl | C. | 蔗糖 | D. | 稀盐酸 |
5.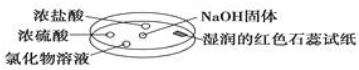 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出来的HCl气体反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| A. | A | B. | B | C. | C | D. | D |