题目内容
现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”“=”或“<”).
(2)减压时,A的质量分数 .(填“增大”“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率 ,B的转化率 .
(4)若升高温度,则平衡时B、C的浓度之比
将 .
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ;而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”).
(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若容积不变加入B,则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比
| c(B) |
| c(C) |
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热;
当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和;
(2)减小压强平衡逆移;
(3)加入B(体积不变),平衡向正反应移动,其它反应物的转化率增大,自身转化率降低;
(4)升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大;
(5)催化剂不影响平衡移动,根据外界条件对化学平衡的影响解答该题;
(6)加入C(体积不变)时,平衡向逆反应方向进行,B的浓度增大;维持容器内压强不变,充入氖气,容器体积增大,B的浓度降低.
当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和;
(2)减小压强平衡逆移;
(3)加入B(体积不变),平衡向正反应移动,其它反应物的转化率增大,自身转化率降低;
(4)升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大;
(5)催化剂不影响平衡移动,根据外界条件对化学平衡的影响解答该题;
(6)加入C(体积不变)时,平衡向逆反应方向进行,B的浓度增大;维持容器内压强不变,充入氖气,容器体积增大,B的浓度降低.
解答:
解:(1)达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,逆反应为放热反应,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和;
故答案为:放;>;
(2)当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则BAD质量分数增大,故答案为:增大;
(3)加入B(体积不变),平衡向正反应移动,A的转化率增大,B自身转化率减小,故答案为:增大;减小;
(4)升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大,故
减小,故答案为:减小;
(5)催化剂只能加快化学反应速率,不影响平衡移动,故答案为:不变;
(6)加入C(体积不变)时,化学平衡正向移动,所以混合物颜色加深;维持容器内压强不变,充入氖气,容器体积增大,B的浓度降低,气体的颜色变浅;
故答案为:变深;变浅.
故答案为:放;>;
(2)当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则BAD质量分数增大,故答案为:增大;
(3)加入B(体积不变),平衡向正反应移动,A的转化率增大,B自身转化率减小,故答案为:增大;减小;
(4)升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大,故
| c(B) |
| c(C) |
(5)催化剂只能加快化学反应速率,不影响平衡移动,故答案为:不变;
(6)加入C(体积不变)时,化学平衡正向移动,所以混合物颜色加深;维持容器内压强不变,充入氖气,容器体积增大,B的浓度降低,气体的颜色变浅;
故答案为:变深;变浅.
点评:本题考查了外界条件对化学平衡的影响等,注意基础知识的理解掌握,注意催化剂不影响平衡移动,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
通过复习总结,你认为下列对化学知识概括合理的是( )
| A、金属氧化物都是强电解质 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 |
| D、能与金属镁反应产生氢气的溶液一定是酸溶液 |
下列说法正确的是( )
| A、已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | ||||||||||
| B、已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有:c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 mol2/L2 | ||||||||||
| C、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因可能是NH4+结合OH-使沉淀溶解平衡发生移动 | ||||||||||
D、已知:
 (g)+3H2(g)→ (g)+3H2(g)→ (g) 的焓变 (g) 的焓变 |
某有机物是药物生产的中间体,其结构如图.下列有关叙述不正确的是( )
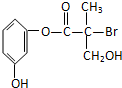

| A、该有机物与浓溴水可发生取代反应,1 mol该有机物可消耗3 mol溴 |
| B、该有机物与浓硫酸混合共热可发生消去反应 |
| C、1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| D、1 mol该有机物催化加氢最多消耗3 mol氢气 |
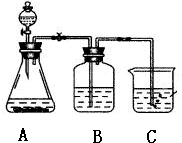 某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
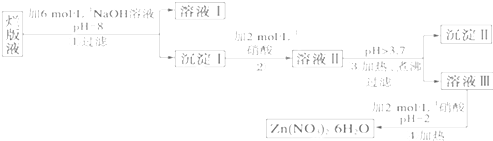
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验: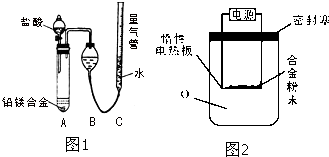 为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.
为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.