题目内容
10.下列说法正确的是( )| A. | 离子化合物都是强电解质 | |
| B. | 水溶液能导电的物质都是电解质 | |
| C. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| D. | 浓度一定的强电解质溶液,升高温度时其导电性增强 |
分析 A.离子化合物是阴阳离子过程的化合物,水溶液中或熔融状态下完全电离能导电;
B.非电解质的水溶液也可以导电;
C.溶液导电性取决于溶液中离子浓度大小,和电解质强弱无直接关系;
D.升高温度溶液中的离子移动速率加快导电性增强;
解答 解:A.绝大多数的离子化合物是强电解质,故A正确;
B.有些非电解质如SO2、CO2 、NH3在溶于水时与水反应生成了电解质而导电,水溶液能导电的物质不都是电解质,故B错误;
C.溶液导电性与电解质的强弱无关,只与溶液中的离子浓度有关,弱电解质溶液中离子浓度也可能很大,故其导电性就强,很稀的盐酸导电性可能就很弱,故C错误;
D.升高温度溶液中的离子移动速率加快导电性增强,但升高温度时其导电性不一定增强,如盐酸溶液升温氯化氢挥出,导电性减弱,故D错误;
故选A.
点评 本题考查了强弱电解质的概念实质、溶液导电性影响因素,注意积累知识,掌握基础是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列说法正确的是( )
| A. | 硅是构成岩石和许多矿物的基本元素 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 二氧化硅的化学性质很不活泼,不能与强碱反应生成盐 |
18.现有乙醛(CH3CHO)、乙酸、乙烯和丙烯(C3H6)的混合物,其中氧的质量分数为α,则碳的质量分数是( )
| A. | $\frac{(1-α)}{7}$ | B. | $\frac{6}{7}(1-α)$ | C. | $\frac{12}{13}(1-α)$ | D. | α |
5.H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示,下列说法正确的是( )


| A. | 等浓度的H2CO3、Na2CO3溶液中c(HCO3-)前者小 | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-5.37 | |
| C. | 1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合,混合液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | Na2CO3溶液中加入过量草酸溶液,发生反应:CO32-+H2C2O4═HCO3-+HC2O4- |
5.下列关于铜电极的叙述正确的是( )
| A. | 用电解法精炼铜时,粗铜做阴极 | |
| B. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| C. | 在镀件上电镀铜时,可用金属铜做阳极 | |
| D. | 在电解池中,铜做阳极时,溶液中的阴离子在铜极上失电子 |
9.下列物质,不属于醇类的是( )
| A. | CH6-CH2OH | B. | C6H5OH | C. | C2H5OH | D. |  |
10.在光照条件下,将1mol CH4与Cl2反应,得到等物质的量的4种取代物,则耗Cl2物质的量为( )
| A. | 1 mol | B. | 2 mol | C. | 2.5 mol | D. | 10 mol |
 (1)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B);反应可能经历了生成中间体(Ⅰ),过程如图所示.在A~F 6个反应中,属于加成反应的是CE(填字母).
(1)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B);反应可能经历了生成中间体(Ⅰ),过程如图所示.在A~F 6个反应中,属于加成反应的是CE(填字母). +H2O,反应类型为取代反应;
+H2O,反应类型为取代反应; )发生下列反应的方程式:
)发生下列反应的方程式: ,
, ;
; 的单体为
的单体为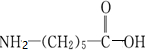 ,反应类型为缩聚反应.
,反应类型为缩聚反应.