题目内容
19.金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代.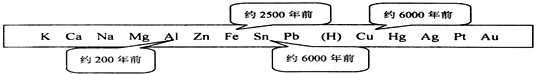
(1)根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟③有关(填编号)
①金属的导热性 ②金属元素在地壳中的含量 ③金属的活动性顺序 ④金属的延展性
(2)钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色 Fe3+.这个变色的过程中的Fe2+被氧化 (填“氧化”或“还原”).若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生.这说明维生素C具有:B.
A.氧化性 B.还原性 C.酸性 D.碱性
(3)比较铝铁活泼性,用一个实验事实说明:相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼;
但是铝在空气中却表现出很强的抗氧化性,其原因是铝的表面生成一层致密的氧化膜;
复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应,写出氢氧化铝的电离方程式AlO2-+H++H2O?Al(OH)3?Al3++3OH-.
(4)冶炼金属常用以下几种方法:①以C或CO、H2作还原剂还原;②电解法;③热分解法;④铝热反应.现冶炼下列金属,请分别填写该金属冶炼方法的序号:铝②、铁①、汞③、钨④.
分析 (1)根据金属冶炼方法判断;
(2)一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳;Fe2+变为棕黄色 Fe3+,Fe元素的化合价升高;防止Fe被氧化需要加还原剂;
(3)金属活泼性越强,与酸反应越剧烈;Al的表面能形成致密的氧化膜;氢氧化铝能发生碱式电离和酸式电离;
(4)金属的活泼性不同采用不同的方法.
解答 解:(1)金属的活动性越强,冶炼的程度越难,利用的越晚,所以金属大规模开发利用的先后顺序跟金属的活动性顺序;
故答案为:③;
(2)一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,其反应的方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;Fe2+变为棕黄色 Fe3+,Fe元素的化合价升高,所以变色的过程中的Fe2+被氧化;防止Fe被氧化需要加还原剂,加入适量的维生素C可以还原铁离子,则维生素C作还原剂,有还原性;
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;氧化;C;
(3)金属活泼性越强,与酸反应越剧烈,相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼;
铝在空气中易被氧气氧化使表面生成致密的氧化物保护膜;氢氧化铝能发生碱式电离电离出铝离子和氢氧根离子,发生酸式电离出偏铝酸根离子和氢离子,其电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
故答案为:相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼;铝的表面生成一层致密的氧化膜;AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
(4)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼;Na、Mg、Al等活泼或较活泼金属的化合物与C、CO或H2等不反应,故采用电解法冶炼制备;Hg、Ag等不活泼金属的氧化物不稳定,受热易分解,故采用热分解法冶炼;V、Cr、Mn、W等高熔点金属可利用铝热反应产生的高温来冶炼;
故答案为:②、①、③、④.
点评 本题考查了金属的冶炼、氧化还原反应、铝的化合物的性质等,题目难度不大,注意金属的活泼性不同,冶炼方法不同,活泼金属采用电解法冶炼,不活泼的金属采用直接加热法冶炼,大部分金属的冶炼都是在高温下采用氧化还原反应法.

| A. | N、O、F元素非金属性依次减弱 | |
| B. | Na、Mg、Al元素最高化合价依次升高 | |
| C. | Na、Li、K原子的电子层数依次增多 | |
| D. | P、Cl、S元素最高价氧化物对应的水化物酸性依次增强 |
| A. | Fe3+ 的水溶液为棕黄色,可用含SCN-的溶液检验 | |
| B. | 用玻璃棒蘸取溶液,滴在湿润的pH试纸上测定溶液的pH值 | |
| C. | 中和滴定用的锥形瓶用待测溶液润洗C | |
| D. | 除去Fe2O3中混有的少量Al2O3可用盐酸 |
| A. | 两块铁片上均有铜析出 | B. | 两块铁片上均无铜析出 | ||
| C. | 浸过浓H2SO4 的铁片上有铜析出 | D. | 浸过浓H2SO4 的铁片上无铜析出 |
| A. | Fe3+、K+、S2-、SO42- | B. | Na+、K+、AlO2-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Na+、K+、CO32-、SO42- |
| A. | 主要学习实验方法,体验一下实验操作即可,不必追求精确 | |
| B. | 应该先做好实验报告,并事先填好,再做实验 | |
| C. | 要实事求是地记录自己的测定结果 | |
| D. | 本组实验失误,实验报告可以参照邻组的结果 |
| A. | NaHSO4和Ba(OH)2 | B. | AlCl3和NaOH | C. | Ba(HCO3)2和Ba(OH)2 | D. | NaAlO2和H2SO4 |
| A. | 所有的酸和碱都能使指示剂变色 | |
| B. | 物质发生缓慢氧化时一定放出热量 | |
| C. | 检测某溶液的pH时,pH试纸要预先用水湿润 | |
| D. | 一氧化碳还原氧化铜后试管壁上留下的红色物质,用稀硫酸浸泡除去 |
 如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )
如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )| A. | 原子半径Y>Z | B. | WZ2能使酸性高锰酸钾溶液褪色 | ||
| C. | X的氢化物比Y的氢化物稳定 | D. | W元素氧化物的水化物一定是强酸 |