题目内容
某废液中含有![]() 等离子,设计一个实验方案,将
等离子,设计一个实验方案,将![]() 变为Ag而分离出来,把
变为Ag而分离出来,把![]() 还原成铜,同时需制出绿矾晶体.简述实验步骤(可列表说明).
还原成铜,同时需制出绿矾晶体.简述实验步骤(可列表说明).
答案:

练习册系列答案
相关题目
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.Ⅰ.废液组成:
| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g?L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:
③此步骤中必须控制好NaClO溶液的用量,其原因可能是
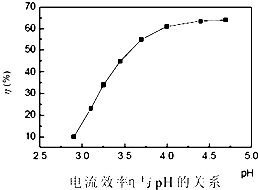
步骤3:回收镍以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍粉.电解过程中电流效率与pH的关系如图,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:
②电解的最佳pH范围是:
A.3.0~3.5 B.3.5~4.0 C.4.0~4.5 D.4.5~5.0.
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
Ⅰ.废液组成:
| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g?L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是________.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:________.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:________;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:________.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是________.
步骤3:回收镍以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍粉.电解过程中电流效率与pH的关系如图,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:________.
②电解的最佳pH范围是:________(填序号).
A.3.0~3.5 B.3.5~4.0 C.4.0~4.5 D.4.5~5.0.
